Documents below will show that research to create COVID 19 began in the United States in 2006 and culminated in a successful bio-weapon in 2015, with work done at the University of North Carolina and at Harvard and at the Food and Drug Administration’s lab in Arkansas. Their work was titled:
A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence
They did this and more, so much more as you will read below.
As Trump said, over and over and over, the Chinese were involved.
Key Laboratory of Special Pathogens and Biosafety, Wuhan Institute of Virology, Chinese Academy of Sciences, Wuhan, China supplied the Wuhan Bat Virus which was used in the American study. Their name was included for that reason only.
COVID 19 was a US Army bio-weapons project to manufacture a pneumonia causing disease that would be nearly impossible to vaccinate for in patients over 40 years old.
The proof is here, simply scroll down. The study was run by the University of North Carolina and funded by USAID/CIA. It chose a Chinese bat virus and chose to include a medical facility in Wuhan as well.
Now we know why, a smokescreen of blame for a program China had little or nothing to do with, something satanically evil and purely American.
In November 2015, a study was published outlining the capability of producing the virus we are dealing with now. Among the many involved was a lab in Wuhan, China. It was listed from the beginning as one of dozens, mostly American, working on this project.
However, one key participant was left out, USAID. It is suspected, deeply so, that USAID is a front for American bio-warfare research such as that done in Tbilisi, Georgia and elsewhere, much documented. This is the citation which adds USAID to the research funding group.
Change history
20 November 2015
In the version of this article initially published online, the authors omitted to acknowledge a funding source, USAID-EPT-PREDICT funding from EcoHealth Alliance, to Z.-L.S. The error has been corrected for the print, PDF and HTML versions of this article.
We will now present Pravda’s biased article and, below that, the actual study proving the capability of producing COVID 19, proving it is not a naturally occurring virus once and for all.
As to who did what, this is not our job but we are proving, categorically, that when a Chinese lab is mentioned, it is a minor player in an American effort, as outlined exhaustively below.
This makes any discussing the Wuhan lab possibly complicit in bio-warfare.
Similarly, when Forbes Magazine and others stated they could prove COVID 19 was made naturally, and of course they had the same access we have, we suspect that they are part of a disinformation effort tied to USAID and bio-warfare.
Suspicion is not proof. Proof is proof and there is proof enough to drown in. Our thanks to the American medical professionals who pimped themselves out to the US Army and CIA and who helped bring us where we are now, a nation broken to pieces.
Pravda.Ru: Such material appeared in 2015 on the website of the scientific journal Natura in 2015. Then the authors claimed that after the advent of the SARS virus (2002-2003) and the Middle East respiratory syndrome (MERS), scientists were aware of the risk of interspecific transmission that would lead to an epidemic among people.
Successful lab experiment
Among other things, the research team studied bats, which are the largest incubators of coronaviruses. Nevertheless, bats could not transmit the coronavirus to humans because they could not interact with human cells with ACE2 receptors.
The material also stated that horseshoe bats carry a strain of SARS coronavirus that can be transmitted to humans. It has been named the SHC014-CoV virus.
To better study this virus, scientists copied the coronavirus and infected it with laboratory mice. The results showed that the virus is really able to bind to human cells with ACE2 receptors and multiply in the cells of the respiratory system.
In the research work, it is noted that laboratory materials, samples and equipment that were used in the research were obtained from the Army Medical Research Institute of Infectious Diseases. Although it is not yet possible to say for sure that the virus that was tested in laboratory mice is the same as the SARS-Cove-2 coronavirus.
NATO policy
However, interesting things can be found in earlier documents. For example:
- The 2019 Alliance’s activity report says that in 2019, the Alliance’s first place in research and development was occupied by the topic of radiochemical and biological protection (29%), shifting the seemingly most pressing problem of Europe – counterterrorism (it turned out to be 4- m priority).
- A year earlier, in 2018, the situation was exactly the opposite: terrorism, as it should be, was in the first place (28%), and radiochemical and biological protection in the fourth (13%).
As the Brussels snitch writes in the telegram channel, “given the absence of visible reasons for such a sharp change in scientific interests, there are two options and both are unpleasant:
- or NATO now wags the fifth point, falsifying the data to show “and we always prepared for viruses, we are modern”,
- or even in 2019 in the alliance, God forgive me, they knew where the trouble would come from.
Yes, the first option is much more real, but, you see, the facts are surprising. “
Читайте больше на https://www.pravda.ru/world/1482450-COVID19/
COVID 19, utworzony w Karolinie Północnej dla Bio-Warfare, opłacony przez CIA i Trump Blames China
Poniższe dokumenty pokażą, że badania nad stworzeniem COVID 19 rozpoczęły się w Stanach Zjednoczonych w 2006 r., A zakończyły się udaną bronią biologiczną w 2015 r., Przy pracach wykonanych na University of North Carolina i na Harvard oraz w laboratorium Food and Drug Administration w Arkansas . Ich praca nosiła tytuł:
Klaster krążących nietoperzy koronawirusów, podobny do SARS, pokazuje możliwość pojawienia się człowieka
Zrobili to i wiele więcej, o wiele więcej, jak przeczytasz poniżej.
Jak mówił Trump, w kółko byli w to zaangażowani Chińczycy.
Kluczowe laboratorium specjalnych patogenów i bezpieczeństwa biologicznego, Wuhan Institute of Virology, Chińska Akademia Nauk, Wuhan, Chiny dostarczyło wirusa nietoperza Wuhan, który zastosowano w amerykańskim badaniu. Ich nazwa została podana tylko z tego powodu.
COVID 19 był projektem armii amerykańskiej dotyczącym broni biologicznej w celu wytworzenia choroby wywołującej zapalenie płuc, która byłaby prawie niemożliwa do zaszczepienia u pacjentów w wieku powyżej 40 lat.
Dowód jest tutaj, po prostu przewiń w dół. Badanie zostało przeprowadzone przez University of North Carolina i finansowane przez USAID / CIA. Wybrał chińskiego wirusa nietoperzy i objął również placówkę medyczną w Wuhan.
Teraz wiemy, dlaczego zasłona dymna winy za program, z którym Chiny miały niewiele lub nic wspólnego, coś satanistycznie złego i czysto amerykańskiego.
W listopadzie 2015 r. Opublikowano badanie, w którym opisano możliwości produkowania wirusa, z którym mamy obecnie do czynienia. Wśród wielu zaangażowanych było laboratorium w Wuhan w Chinach. Od początku był wymieniony jako jeden z kilkudziesięciu, głównie amerykańskich, pracujących nad tym projektem.
Jednak jeden kluczowy uczestnik został pominięty, USAID. Głęboko podejrzewa się, że USAID jest frontem dla amerykańskich badań nad biologią wojną, takich jak te przeprowadzone w Tbilisi, Gruzji i innych krajach, co zostało w dużej mierze udokumentowane. Jest to cytat, który dodaje USAID do grupy finansującej badania.
Zmieniać historię
20 listopada 2015 r
W wersji tego artykułu, pierwotnie opublikowanej online, autorzy pominęli uznanie źródła finansowania, finansowania USAID-EPT-PREDICT od EcoHealth Alliance, do Z.-LS Błąd został poprawiony dla wersji drukowanej, PDF i HTML tego artykułu .
Zaprezentujemy teraz stronniczy artykuł Prawdy, a poniżej faktyczne badanie potwierdzające zdolność do produkcji COVID 19, dowodzące, że nie jest to wirus naturalnie występujący raz na zawsze.
Co do tego, kto to zrobił, nie jest to nasza praca, ale kategorycznie udowadniamy, że kiedy wspomina się o chińskim laboratorium, jest to niewielki gracz w amerykańskim wysiłku, jak to wyczerpująco przedstawiono poniżej.
To sprawia, że wszelkie dyskusje w laboratorium Wuhan mogą brać udział w wojnie biologicznej.
Podobnie, gdy magazyn Forbes i inni stwierdzili, że mogą udowodnić, że COVID 19 został wyprodukowany naturalnie, i oczywiście mieli oni taki sam dostęp, jak my, podejrzewamy, że są one częścią działań dezinformacyjnych związanych z USAID i wojną biologiczną.
Podejrzenie nie jest dowodem. Dowód jest dowodem i jest wystarczający dowód, aby się utopić. Dziękujemy naszym amerykańskim specjalistom medycznym, którzy wyskoczyli do armii USA i CIA i pomogli nam doprowadzić nas tam, gdzie teraz jesteśmy, naród rozpadający się na kawałki.
P ravda.Ru: Taki materiał pojawił się w 2015 r. Na stronie internetowej czasopisma naukowego Natura w 2015 r. Następnie autorzy twierdzili, że po pojawieniu się wirusa SARS (2002-2003) i zespołu oddechowego na Bliskim Wschodzie (MERS) naukowcy świadomy ryzyka przenoszenia międzygatunkowego, które doprowadziłoby do epidemii wśród ludzi.
Udany eksperyment laboratoryjny
Zespół badawczy badał między innymi nietoperze, które są największymi inkubatorami koronawirusów. Niemniej jednak nietoperze nie mogły przekazać koronawirusa ludziom, ponieważ nie mogły oddziaływać z ludzkimi komórkami z receptorami ACE2.
W materiale stwierdzono także, że nietoperze podkowy zawierają szczep koronawirusa SARS, który może być przenoszony na ludzi. Został nazwany wirusem SHC014-CoV.
Aby lepiej zbadać tego wirusa, naukowcy skopiowali koronawirusa i zainfekowali go myszami laboratoryjnymi. Wyniki pokazały, że wirus naprawdę może wiązać się z ludzkimi komórkami za pomocą receptorów ACE2 i namnażać się w komórkach układu oddechowego.
W pracy badawczej zauważono, że materiały laboratoryjne, próbki i sprzęt, które zostały użyte w badaniach zostały uzyskane z Army Medical Research Institute of Infectious Diseases. Chociaż nie można jeszcze stwierdzić z całą pewnością, że wirus przetestowany na myszach laboratoryjnych jest taki sam jak koronawirus SARS-Cove-2.
Polityka NATO
Jednak ciekawe rzeczy można znaleźć we wcześniejszych dokumentach. Na przykład:
- Raport z działalności Sojuszu z 2019 r. Mówi, że w 2019 r. Pierwsze miejsce Sojuszu w badaniach i rozwoju zajmował temat ochrony radiochemicznej i biologicznej (29%), przesuwając pozornie najpilniejszy problem Europy - przeciwdziałanie terroryzmowi (okazało się, że 4 - priorytet m).
- Rok wcześniej, w 2018 roku, sytuacja była dokładnie odwrotna: terroryzm, jak powinien, był na pierwszym miejscu (28%), a ochrona radiochemiczna i biologiczna na czwartym (13%).
Jak pisze bruk z Brukseli w kanale telegramowym, „biorąc pod uwagę brak widocznych przyczyn tak gwałtownej zmiany zainteresowań naukowych, istnieją dwie opcje i obie są nieprzyjemne:
- lub NATO macha teraz piątym punktem, fałszując dane, aby pokazać „i zawsze przygotowywaliśmy się na wirusy, jesteśmy nowocześni”,
- a nawet w 2019 roku w sojuszu, Boże wybacz mi, wiedzieli, skąd będą kłopoty.
Tak, pierwsza opcja jest o wiele bardziej realna, ale widzicie, fakty są zaskakujące. „
Читайте больше на https://www.pravda.ru/world/1482450-COVID19/
Oryginalne badanie z 2015 r. Niezredagowane i kompletne
Klaster krążących nietoperzy koronawirusów, podobny do SARS, pokazuje możliwość pojawienia się człowieka
- Opublikowany:
- https://www.nature.com/articles/nm.3985
- Vineet D Menachery ,
- Boyd L Yount Jr ,
- Kari Debbink ,
- Sudhakar Agnihothram ,
- Lisa E. Graliński ,
- Jessica A Plante ,
- Rachel L. Graham ,
- Trevor Scobey ,
- Xing-Yi Ge ,
- Eric F Donaldson ,
- Scott H Randell ,
- Antonio Lanzavecchia ,
- Wayne A Marasco ,
- Zhengli-Li Shi &
- Ralph S Baric
- Dostęp do 1,05 m
- 94 Cytowania
- 6156 Altmetric
- Szczegóły metryki
- Sprostowanie do tego artykułu została opublikowana w dniu 06 kwietnia 2016
Abstrakcyjny
Pojawienie się ostrego koronawirusa zespołu ostrej niewydolności oddechowej (SARS-CoV) i syndromu oddechowego na Bliskim Wschodzie (MERS) -CoV podkreśla zagrożenie przenoszeniem się różnych gatunków prowadzącym do wybuchów u ludzi. Tutaj badamy potencjał na choroby SARS-jak wirus, SHC014-CoV, który jest aktualnie krążących w populacji chińskiej podkowcowate 1 . Korzystanie z systemu odwrotnej genetyki SARS-CoV 2, wygenerowaliśmy i scharakteryzowaliśmy chimerycznego wirusa wyrażającego skok koronawirusa nietoperza SHC014 w dostosowanym do myszy szkielecie SARS-CoV. Wyniki wskazują, że wirusy grupy 2b kodujące skok SHC014 w szkielecie typu dzikiego mogą skutecznie wykorzystywać wiele ortologów receptora SARS ludzkiego enzymu konwertującego angiotensynę II (ACE2), skutecznie replikować się w pierwotnych ludzkich komórkach dróg oddechowych i osiągać miana in vitro odpowiadające epidemii szczepy SARS-CoV. Dodatkowo in vivo eksperymenty wykazują replikację chimerycznego wirusa w płucach myszy ze znaczną patogenezą. Ocena dostępnych modów immunoterapeutycznych i profilaktycznych opartych na SARS wykazała słabą skuteczność; zarówno w przypadku przeciwciał monoklonalnych, jak i szczepionek nie udało się zneutralizować i chronić przed zakażeniem CoV przy użyciu nowego białka kolca. Na podstawie tych wyników syntetycznie odzyskaliśmy zakaźnego pełnej długości rekombinowanego wirusa SHC014 i wykazaliśmy silną replikację wirusa zarówno in vitro, jak i in vivo . Nasza praca sugeruje potencjalne ryzyko ponownego pojawienia się SARS-CoV w wirusach krążących obecnie w populacjach nietoperzy.
Główny
Pojawienie się SARS-CoV zwiastowało nową erę przenoszenia międzygatunkowego ciężkich chorób układu oddechowego z globalizacją prowadzącą do szybkiego rozprzestrzeniania się na całym świecie i ogromnym wpływem ekonomicznym 3 , 4 . Od tego czasu kilka szczepów - w tym szczepy grypy A H5N1, H1N1 i H7N9 oraz MERS-CoV - wyłoniło się z populacji zwierząt, powodując znaczną chorobę, śmiertelność i trudności ekonomiczne w dotkniętych regionach 5 . Chociaż środki zdrowia publicznego były w stanie zatrzymać wybuch SARS-CoV 4 , ostatnie badania metagenomiczne zidentyfikowały sekwencje blisko spokrewnionych wirusów podobnych do SARS krążących w chińskich populacjach nietoperzy, które mogą stanowić przyszłe zagrożenie 1 , 6. Jednak same dane sekwencji zapewniają minimalny wgląd w identyfikację i przygotowanie do przyszłych wirusów prepandemicznych. Dlatego, aby zbadać potencjał pojawienia się (czyli potencjał zakażenia ludzi) krążących CoV nietoperzy, zbudowaliśmy chimerycznego wirusa kodującego nowe, zoonotyczne białko kolczaste CoV - z sekwencji RsSHC014-CoV, która została wyizolowana z chińskich nietoperzy podkowy 1 —W kontekście szkieletu dostosowanego do myszy SARS-CoV. Wirus hybrydowy pozwolił nam ocenić zdolność nowego białka kolca do wywoływania choroby niezależnie od innych niezbędnych mutacji adaptacyjnych w jego naturalnym szkielecie. Stosując to podejście, scharakteryzowaliśmy zakażenie CoV, w którym pośredniczy białko szpiku SHC014 w pierwotnych ludzkich komórkach dróg oddechowych i in vivooraz przetestował skuteczność dostępnych immunoterapeutyk przeciwko SHC014-CoV. Wspólnie strategia tłumaczy dane metagenomiczne, aby pomóc przewidzieć i przygotować się na przyszłe pojawiające się wirusy.
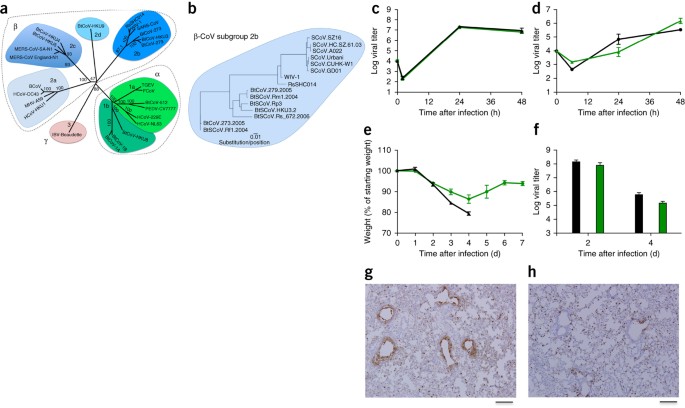
Sekwencje SHC014 i pokrewnych RsWIV1-CoV pokazują, że te CoV są najbliższymi krewnymi w stosunku do epidemicznych szczepów SARS-CoV ( ryc. 1a, b ); istnieją jednak istotne różnice w 14 resztach, które wiążą ludzki ACE2, receptor SARS-CoV, w tym w pięciu, które są krytyczne dla zakresu gospodarza: Y442, L472, N479, T487 i Y491 (ref. 7 ). W WIV1 trzy z tych reszt różnią się od epidemicznego szczepu Urbani SARS-CoV, ale nie oczekiwano, że zmienią wiązanie z ACE2 ( uzupełniająca ryc. 1a, b i uzupełniająca tabela 1 ). Fakt ten potwierdzają oba eksperymenty pseudotypowania, w których mierzono zdolność lentiwirusów kodujących białka szpiku WIV1 do wchodzenia do komórek wyrażających ludzki ACE2 ( rysunek uzupełniający 1)) oraz w testach replikacji WIV1-CoV (ref. 1 ). W przeciwieństwie do tego, 7 z 14 reszt interakcji ACE2 w SHC014 różni się od tych w SARS-CoV, w tym wszystkie pięć reszt krytycznych dla zakresu gospodarza ( rysunek uzupełniający 1c i tabela uzupełniająca 1 ). Zmiany te, w połączeniu z niepowodzeniem pseudotypowanych lentiwirusów wyrażających skok SHC014 do komórek ( dodatkowa ryc. 1d ), sugerują, że skok SHC014 nie jest zdolny do wiązania ludzkiego ACE2. Jednak zgłoszono podobne zmiany w pokrewnych szczepach SARS-CoV, które umożliwiają wiązanie ACE2 7 , 8, co sugeruje, że do weryfikacji wymagane były dodatkowe testy funkcjonalne. Dlatego zsyntetyzowaliśmy skok SHC014 w kontekście zdolnego do replikacji, dostosowanego do myszy szkieletu SARS-CoV (dalej określamy chimeryczny CoV jako SHC014-MA15), aby zmaksymalizować możliwość badań nad patogenezą i szczepionkami u myszy ( rysunek uzupełniający 2a ). Pomimo prognoz z zarówno modelowania opartego na strukturze, jak i eksperymentów pseudotypowania, SHC014-MA15 był żywotny i replikowany do wysokich mian w komórkach Vero ( rysunek uzupełniający 2b ). Podobnie jak SARS, SHC014-MA15 wymagał również funkcjonalnej cząsteczki ACE2 do wejścia i mógł wykorzystywać ortologi ACE2 człowieka, cyweta i nietoperza ( rysunek uzupełniający 2c, d). Aby przetestować zdolność ostrza SHC014 do pośredniczenia w infekcji ludzkich dróg oddechowych, zbadaliśmy wrażliwość ludzkiej linii komórek nabłonkowych dróg oddechowych Calu-3 2B4 (ref. 9 ) na infekcję i znaleźliśmy solidną replikację SHC014-MA15, porównywalną z replikacją SARS-CoV Urbani ( ryc. 1c ). Aby rozszerzyć te odkrycia, pierwotne kultury nabłonka dróg oddechowych człowieka (HAE) zostały zainfekowane i wykazały silną replikację obu wirusów ( ryc. 1d ). Łącznie dane potwierdzają zdolność wirusów z ostrzem SHC014 do infekowania ludzkich komórek dróg oddechowych i podkreślają potencjalne zagrożenie przenoszenia międzygatunkowego SHC014-CoV.
( a ) Sekwencje genomu pełnej długości reprezentatywnych CoV dopasowano i mapowano filogenetycznie, jak opisano w Metodach Online . Pasek skali reprezentuje podstawienia nukleotydów, przy czym znakowane jest tylko wsparcie dla ładowania początkowego powyżej 70%. Drzewo pokazuje CoV podzielone na trzy odrębne grupy filogenetyczne, zdefiniowane jako α-CoV, β-CoV i γ-CoV. Klasyczne klastry podgrup są oznaczone jako 2a, 2b, 2c i 2d dla β-CoV oraz jako 1a i 1b dla α-CoV. ( b ) Sekwencje aminokwasowe domen S1 pików reprezentatywnych β-CoV z grupy 2b, w tym SARS-CoV, zostały wyrównane i mapowane filogenetycznie. Pasek skali reprezentuje podstawienia aminokwasów. ( c , d) Wirusowa replikacja SARS-CoV Urbani (czarna) i SHC014-MA15 (zielona) po zakażeniu komórek Calu-3 2B4 ( c ) lub dobrze zróżnicowanych, pierwotnych kulturach komórek HAE z interfejsem powietrze-ciecz ( d ) przy wielu zakażeniach (MOI) 0,01 dla obu typów komórek. Próbki pobierano w indywidualnych punktach czasowych z powtórzeniami biologicznymi ( n = 3) dla eksperymentów Calu-3 i HAE. ( e , f ) Utrata masy ciała ( n = 9 dla SARS-CoV MA15; n = 16 dla SHC014-MA15) ( e ) i replikacja wirusa w płucach ( n = 3 dla SARS-CoV MA15; n = 4 dla SHC014- MA15) ( f) 10-tygodniowych myszy BALB / c zakażonych z 1 x 10 4 pfu myszy przystosowane SARS CoV MA15 (czarny) lub SHC014-MA15 (zielony) przez donosowe (w) trasy. ( g, h ) Przedstawiono reprezentatywne obrazy skrawków płuc barwionych na antygen SARS-CoV N od myszy zakażonych SARS-CoV MA15 ( n = 3 myszy) ( g ) lub SHC014-MA15 ( n = 4 myszy) ( h ). Dla każdego wykresu wartość środkowa reprezentuje średnią grupy, a słupki błędów określają słupki skali sem, 1 mm.
Aby ocenić rolę ostrza SHC014 w pośredniczeniu w infekcji in vivo , zainfekowaliśmy 10-tygodniowe myszy BALB / c 10 4 jednostkami tworzącymi łysinki (pfu) SARS-MA15 lub SHC014-MA15 ( ryc. 1e – h ). Zwierzęta zakażone SARS-MA15 doświadczyły szybkiej utraty wagi i śmiertelności przez 4 dni po zakażeniu (dpi); przeciwnie, zakażenie SHC014-MA15 spowodowało znaczną utratę masy ciała (10%), ale nie powodowało śmiertelności u myszy ( ryc. 1e ). Badanie replikacji wirusa ujawniło prawie równoważne miana wirusa z płuc myszy zakażonych SARS-MA15 lub SHC014-MA15 ( ryc. 1f ). Podczas gdy płuca myszy zakażonych SARS-MA15 wykazały silne barwienie zarówno w końcowych oskrzelach, jak i miąższu płucnym 2 dpi ( ryc. 1g) myszy zakażonych SHC014-MA15 wykazały zmniejszone barwienie antygenem w drogach oddechowych ( ryc. 1h ); przeciwnie, nie zaobserwowano deficytu w barwieniu antygenu w miąższu ani w ogólnej punktacji histologicznej, co sugeruje różnicowe zakażenie tkanki płucnej dla SHC014-MA15 ( tabela uzupełniająca 2 ). Następnie przeanalizowaliśmy infekcję u bardziej podatnych, starszych (12-miesięcznych) zwierząt. Zwierzęta zakażone SARS-MA15 gwałtownie straciły na wadze i uległy infekcji ( ryc. 3a, b ). Zakażenie SHC014-MA15 indukowało mocną i trwałą utratę masy ciała, ale miało minimalną śmiertelność. Tendencje w histologii i wzorcach barwienia antygenów, które zaobserwowaliśmy u młodych myszy, zostały zachowane u starszych zwierząt ( tabela uzupełniająca 3). Wykluczyliśmy możliwość, że SHC014-MA15 pośredniczy w infekcji poprzez alternatywny receptor na podstawie eksperymentów z użyciem myszy Ace2 - / - , które nie wykazały utraty masy ciała ani barwienia antygenem po zakażeniu SHC014-MA15 ( uzupełniająca ryc. 4a, b i uzupełniająca Tabela 2 ). Razem dane wskazują, że wirusy z ostrzem SHC014 są zdolne do indukowania utraty wagi u myszy w kontekście zjadliwego szkieletu CoV.
Biorąc pod uwagę przedkliniczną skuteczność terapii przeciwciałem monoklonalnym Ebola, takich jak ZMApp 10 , następnie staraliśmy się określić skuteczność przeciwciał monoklonalnych SARS-CoV przeciwko zakażeniu SHC014-MA15. Wcześniej zgłoszono cztery szeroko neutralizujące ludzkie przeciwciała monoklonalne atakujące białko szpiku SARS-CoV i są prawdopodobnymi odczynnikami do immunoterapii 11 , 12 , 13 . Zbadaliśmy wpływ tych przeciwciał na replikację wirusa (wyrażoną jako procentowe zahamowanie replikacji wirusa) i stwierdziliśmy, że podczas gdy SARS-CoV Urbani typu dzikiego był silnie neutralizowany przez wszystkie cztery przeciwciała przy stosunkowo niskich stężeniach przeciwciał ( ryc. 2a – d), neutralizacja różniła się dla SHC014-MA15. Fm6, przeciwciało wytworzone przez prezentację na fagu i ucieczkę mutantów 11 , 12 , osiągało jedynie poziomy tła hamowania replikacji SHC014-MA15 ( ryc. 2a ). Podobnie, przeciwciała 230.15 i 227.14, które pochodzą z komórek pamięci B pacjentów zakażonych SARS-CoV 13 , również nie zablokowały replikacji SHC014-MA15 ( ryc. 2b, c). Dla wszystkich trzech przeciwciał różnice między sekwencjami szczytowymi aminokwasów SARS i SHC014 odpowiadały bezpośrednim lub sąsiednim zmianom reszt stwierdzonym w mutantach uciekających SARS-CoV (fm6 N479R; 230,15 L443V; 227,14 K390Q / E), co prawdopodobnie tłumaczy brak przeciwciał „aktywność neutralizująca wobec SHC014. Wreszcie, przeciwciało monoklonalne 109,8 było w stanie osiągnąć 50% neutralizację SHC014-MA15, ale tylko przy wysokich stężeniach (10 μg / ml) ( ryc. 2d ). Razem wyniki pokazują, że zasadniczo neutralizujące przeciwciała przeciwko SARS-CoV mogą mieć jedynie marginalną skuteczność w stosunku do pojawiających się szczepów CoV podobnych do SARS, takich jak SHC014.
( a - d ) Testy neutralizacji oceniające skuteczność (mierzoną jako zmniejszenie liczby łysinek) panelu przeciwciał monoklonalnych, które wszystkie zostały pierwotnie wytworzone przeciwko epidemicznemu SARS-CoV, przeciwko zakażeniu komórek Vero SARS-CoV Urbani (czarny) lub SHC014-MA15 (zielony). Testowane przeciwciała to fm6 ( n = 3 dla Urbani; n = 5 dla SHC014-MA15) 11 , 12 ( a ), 230,15 ( n = 3 dla Urbani; n = 2 dla SHC014-MA15) ( b ), 227,15 ( n = 3 dla Urbani; n = 5 dla SHC014-MA15) ( c ) i 109,8 ( n = 3 dla Urbani; n = 2 dla SHC014-MA15) 13 ( d ). Każdy punkt danych reprezentuje średnią grupy, a słupki błędów określają sem. Zauważ, że słupki błędów w komórkach Vero zainfekowanych SARS-CoV Urbani w b , c pokrywają się z symbolami i nie są widoczne.
Aby ocenić skuteczność istniejących szczepionek przeciwko zakażeniu SHC014-MA15, zaszczepiliśmy starzejące się myszy podwójnie inaktywowaną całością SARS-CoV (DIV). Poprzednie prace wykazały, że DIV może neutralizować i chronić młode myszy przed prowokacją homologicznym wirusem 14 ; jednak szczepionka nie chroniła starych zwierząt, u których zaobserwowano również zwiększoną patologię immunologiczną, co wskazuje na możliwość skrzywdzenia zwierząt z powodu szczepienia 15 . Tutaj stwierdziliśmy, że DIV nie zapewnił ochrony przed prowokacją SHC014-MA15 w odniesieniu do utraty wagi lub miana wirusa ( Dodatkowa ryc. 5a, b ). Zgodny z poprzednim raportem z innymi heterologicznymi CoV grupy 2b 15, surowica od starych, zaszczepionych DIV myszy również nie neutralizowała SHC014-MA15 ( uzupełniająca ryc. 5c ). W szczególności szczepienie DIV spowodowało silną patologię immunologiczną ( tabela uzupełniająca 4 ) i eozynofilię ( rysunek uzupełniający 5d – f ). Łącznie wyniki te potwierdzają, że szczepionka DIV nie ochroniłaby przed zakażeniem SHC014 i mogłaby potencjalnie zwiększyć chorobę w zaszczepionej grupie wiekowej.
W przeciwieństwie do szczepienia myszy DIV, zastosowanie SHC014-MA15 jako żywej, atenuowanej szczepionki wykazało potencjalną ochronę krzyżową przed prowokacją SARS-CoV, ale wyniki mają ważne zastrzeżenia. Mamy młodych myszy zakażonych z 10 4 PFU SHC014-MA15 i obserwowano ich przez 28 dni. Następnie zakwestionowaliśmy myszy SARS-MA15 w dniu 29 ( rysunek uzupełniający 6a ). Wcześniejsze zakażenie myszy wysoką dawką SHC014-MA15 zapewniało ochronę przed prowokacją śmiertelną dawką SARS-MA15, chociaż reakcja wywołana przez surowice odpornościowe wywołała 28 dni po zakażeniu SHC014-MA15 tylko minimalnie ( Uzupełnienie ryc. 6b, 1: 200). W przypadku braku wtórnego wzmocnienia antygenu, 28 dpi reprezentuje oczekiwany pik mian przeciwciał i oznacza, że będzie zmniejszona ochrona przed SARS-CoV w czasie 16 , 17 . Podobne wyniki pokazujące ochronę przed prowokacją śmiertelną dawką SARS-CoV zaobserwowano u starszych myszy BALB / c w odniesieniu do utraty wagi i replikacji wirusa ( dodatkowa ryc. 6c, d ). Jednakże SHC014-MA15 Zakażenie Dawka 10 4 pfu wywołane> 10% utraty masy ciała i śmiertelności u niektórych zwierząt w wieku ( fig. 1 i uzupełniający Fig. 3). Stwierdziliśmy, że szczepienie niższą dawką SHC014-MA15 (100 pfu) nie indukowało utraty wagi, ale również nie chroniło starszych zwierząt przed prowokacją dawką śmiertelną SARS-MA15 ( Uzupełniająca ryc. 6e, f ). Razem dane sugerują, że prowokacja SHC014-MA15 może zapewniać ochronę krzyżową przeciwko SARS-CoV poprzez konserwowane epitopy, ale wymagana dawka indukuje patogenezę i wyklucza stosowanie jako szczepionki atenuowanej.
Po ustaleniu, że skok SHC014 ma zdolność do pośredniczenia w infekcji komórek ludzkich i wywoływania choroby u myszy, następnie zsyntetyzowaliśmy pełnej długości zakaźny klon SHC014-CoV w oparciu o podejście zastosowane dla SARS-CoV ( ryc. 3a ) 2 . Replikacja w komórkach Vero nie wykazała deficytu dla SHC014-CoV w stosunku do tego dla SARS-CoV ( ryc. 3b ); jednak SHC014-CoV był znacząco ( P <0,01) osłabiony w pierwotnych hodowlach HAE zarówno po 24, jak i 48 godzinach po zakażeniu ( ryc. 3c ). Zakażenie myszy in vivo nie wykazało znaczącej utraty wagi, ale wykazało zmniejszoną replikację wirusa w płucach pełnej długości zakażenia SHC014-CoV w porównaniu z SARS-CoV Urbani ( ryc. 3d, e). Razem wyniki potwierdzają żywotność pełnej długości SHC014-CoV, ale sugerują, że konieczna jest dalsza adaptacja, aby jej replikacja była równoważna z epidemią SARS-CoV w ludzkich komórkach oddechowych i myszach.
( a ) Schemat molekularnego klonu SHC014-CoV, który został zsyntetyzowany jako sześć ciągłych cDNA (oznaczonych SHC014A, SHC014B, SHC014C, SHC014D, SHC014E i SHC014F) flankowanych przez unikalne miejsca BglI, które pozwoliły na ukierunkowany montaż pełnej długości cDNA wyrażającego się otwarte ramki odczytu (dla 1a, 1b, piku, 3, koperty, macierzy, 6–8 i nukleokapsydu). Podkreślone nukleotydy reprezentują sekwencje wystające utworzone po cięciu enzymem restrykcyjnym. ( b , c ) Wirusowa replikacja SARS-CoV Urbani (czarna) lub SHC014-CoV (zielona) po zakażeniu komórek Vero ( b ) lub dobrze zróżnicowanych, pierwotnych kulturach komórkowych interfejsu HAE ( c)) przy MOI 0,01. Próbki pobierano w indywidualnych punktach czasowych z powtórzeniami biologicznymi ( n = 3) dla każdej grupy. Dane reprezentują jeden eksperyment dla komórek Vero i HAE. ( d , e ) Utrata masy ciała ( n = 3 dla SARS-CoV MA15, n = 7 dla SHC014-CoV; n = 6 dla SARS-Urbani) ( d ) i replikacja wirusa w płucach ( n = 3 dla SARS-Urbani i SHC014-CoV), ( e ) 10-tygodniowych myszy BALB / c myszy zakażonej 1 x 10 5 pfu SARS-CoV, MA15 (szary) SHC014 cov (zielony) lub SARS CoV Urbani (czarne) przez W trasie. Każdy punkt danych reprezentuje średnią grupy, a słupki błędów definiują sem **P <0,01 i *** P <0,001 z zastosowaniem dwustronnego testu t- Studenta poszczególnych punktów czasowych.
Podczas epidemii SARS-CoV szybko ustanowiono powiązania między cewkami palmowymi a szczepami CoV wykrytymi u ludzi 4 . Opierając się na tym odkryciu, powszechny paradygmat wschodzenia dowodzi, że epidemia SARS-CoV powstała jako wirus nietoperza, przeskoczyła do cywetów i wprowadziła zmiany w domenie wiążącej receptor (RBD), aby poprawić wiązanie z cywetem Ace2 (ref. 18 ). Późniejsza ekspozycja na ludzi na rynkach żywych zwierząt pozwoliła na zakażenie człowieka szczepem cyweta, który z kolei przystosował się, by stać się szczepem epidemicznym ( ryc. 4a ). Analiza filogenetyczna sugeruje jednak, że wczesne ludzkie szczepy SARS wydają się być bliżej spokrewnione ze szczepami nietoperzy niż ze szczepami cywetowymi 18. Dlatego drugi paradygmat dowodzi, że bezpośrednia transmisja nietoperz-człowiek zapoczątkowała pojawienie się SARS-CoV i że cywile palmowe służyły jako wtórny gospodarz i rezerwuar dla dalszego zakażenia ( ryc. 4b ) 19 . W przypadku obu paradygmatów adaptacja pików w gospodarzu wtórnym jest postrzegana jako konieczność, przy czym spodziewana jest większość mutacji w obrębie RBD, co ułatwia poprawę infekcji. Obie teorie sugerują, że pule CoV nietoperzy są ograniczone, a mutacje w zakresie gospodarza są losowe i rzadkie, co zmniejsza prawdopodobieństwo przyszłych zdarzeń wschodzących u ludzi.
Szczepy koronawirusa są utrzymywane w pulach quasi-gatunkowych krążących w populacjach nietoperzy. ( a , b ) Tradycyjne teorie wschodzenia SARS-CoV zakładają, że mutanty o zasięgu gospodarza (czerwone kółko) reprezentują losowe i rzadkie zdarzenia, które pozwalają na zakażenie alternatywnych gospodarzy. Paradygmat gospodarza wtórnego ( a ) dowodzi, że gospodarz inny niż człowiek jest zakażony wirusem progenitorowym nietoperza i, poprzez adaptację, ułatwia przenoszenie na ludzi; późniejsza replikacja u ludzi prowadzi do epidemicznego szczepu wirusowego. Bezpośredni paradygmat ( ur) sugeruje, że przenoszenie zachodzi między nietoperzami a ludźmi bez wymogu gospodarza pośredniego; selekcja zachodzi następnie w populacji ludzkiej, przy czym blisko spokrewnione wirusy replikują się w gospodarzu wtórnym, umożliwiając ciągłe utrzymywanie się wirusa i adaptację w obu przypadkach. ( c ) Dane z chimerycznych wirusów podobnych do SARS dowodzą, że pule quasi-gatunkowe utrzymują wiele wirusów zdolnych do infekowania komórek ludzkich bez potrzeby mutacji (czerwone kółka). Chociaż adaptacja u wtórnych lub ludzkich gospodarzy może być wymagana do pojawienia się epidemii, jeśli wirusy zawierające kolec SHC014 zrekombinowane z zjadliwym szkieletem CoV (kółka z zielonymi konturami), choroba epidemiczna może być skutkiem u ludzi. Istniejące elementy obsługi danych wszystkich trzech paradygmatów.
Chociaż nasze badanie nie unieważnia innych dróg wschodzenia, argumentuje za trzecim paradygmatem, w którym krążące pule CoV nietoperzy utrzymują „gotowe” białka kolców, które są zdolne do zakażenia ludzi bez mutacji lub adaptacji ( ryc. 4c ). Tę hipotezę ilustruje zdolność chimerycznego wirusa zawierającego ostrze SHC014 w szkielecie SARS-CoV do wywoływania silnej infekcji zarówno w hodowlach ludzkich dróg oddechowych, jak i myszy bez adaptacji RBD. W połączeniu z obserwacją wcześniej zidentyfikowanych patogennych kręgosłupa CoV 3 , 20, nasze wyniki sugerują, że materiały wyjściowe wymagane dla wschodzących szczepów podobnych do SARS krążą obecnie w zbiornikach zwierzęcych. Warto zauważyć, że chociaż SHC014-CoV pełnej długości prawdopodobnie wymaga dodatkowej adaptacji kręgosłupa w celu mediacji ludzkiej choroby, udokumentowane zdarzenia rekombinacji o wysokiej częstotliwości w rodzinach CoV podkreślają możliwość przyszłego pojawienia się i potrzebę dalszego przygotowania.
Do tej pory ekrany genomiczne populacji zwierząt były wykorzystywane przede wszystkim do identyfikacji nowych wirusów w warunkach epidemii 21. Podejście tutaj rozszerza te zbiory danych, aby zbadać kwestie pojawienia się wirusa i skuteczności terapeutycznej. Uważamy, że wirusy z ostrzem SHC014 stanowią potencjalne zagrożenie ze względu na ich zdolność do replikacji w pierwotnych kulturach ludzkich dróg oddechowych, najlepszym dostępnym modelu chorób ludzkich. Ponadto obserwowana patogeneza u myszy wskazuje na zdolność wirusów zawierających SHC014 do wywoływania choroby w modelach ssaków, bez adaptacji RBD. Warto zauważyć, że tropizm różnicowy w płucach w porównaniu z SARS-MA15 i osłabienie pełnej długości SHC014-CoV w hodowlach HAE względem SARS-CoV Urbani sugeruje, że czynniki poza wiązaniem ACE2 - w tym proces szczytowy, biodostępność receptora lub antagonizm odpowiedzi immunologicznych gospodarza - może przyczynić się do pojawienia się. Jednak, wymagane są dalsze badania na naczelnych nie będących ludźmi, aby przełożyć te odkrycia na potencjał patogenny u ludzi. Co ważne, niepowodzenie dostępnych środków terapeutycznych określa krytyczną potrzebę dalszych badań i rozwoju terapii. Dzięki tej wiedzy można opracować programy nadzoru, odczynniki diagnostyczne i skuteczne metody leczenia, które chronią przed pojawieniem się CoV specyficznych dla grupy 2b, takich jak SHC014, i można je zastosować do innych gałęzi CoV, które utrzymują podobnie niejednorodne pule.
Oprócz oferowania przygotowań do przyszłych pojawiających się wirusów, podejście to należy rozważyć w kontekście zleconej przez rząd USA przerwy w zdobywaniu funkcji (GOF) 22 . Na podstawie poprzednich modeli wschodzenia ( ryc. 4a, b ) nie oczekiwano, że tworzenie chimerycznych wirusów, takich jak SHC014-MA15, zwiększy patogeniczność. Chociaż SHC014-MA15 jest osłabiony w stosunku do SARS-CoV dostosowanego do myszy rodzicielskich, podobne badania badające patogenność CoV z dzikim kolcem Urbani w obrębie szkieletu MA15 wykazały brak utraty masy u myszy i zmniejszoną replikację wirusa 23 . Tak więc, w odniesieniu do skoku Urbani – MA15 CoV, SHC014-MA15 wykazuje wzrost patogenezy ( ryc. 1)). Na podstawie tych ustaleń panele naukowe mogą uznać podobne badania budujące wirusy chimeryczne oparte na krążących szczepach za zbyt ryzykowne, ponieważ nie można wykluczyć zwiększonej patogeniczności w modelach ssaków. W połączeniu z ograniczeniami dotyczącymi szczepów przystosowanych do myszy i rozwojem przeciwciał monoklonalnych przy użyciu mutantów uciekających, badania nad pojawieniem się CoV i skuteczności terapeutycznej mogą być poważnie ograniczone w dalszym ciągu. Łącznie te dane i ograniczenia stanowią skrzyżowanie obaw badawczych GOF; potencjał przygotowania się na przyszłe epidemie i łagodzenia go należy porównać z ryzykiem stworzenia bardziej niebezpiecznych patogenów. Opracowując polityki idące naprzód,
Ogólnie rzecz biorąc, nasze podejście wykorzystało dane metagenomiczne do zidentyfikowania potencjalnego zagrożenia stwarzanego przez krążący nietoperz podobny do SARS CoV SHC014. Ze względu na zdolność chimerycznych wirusów SHC014 do replikacji w hodowlach ludzkich dróg oddechowych, powodowania patogenezy in vivo i ucieczki przed obecnymi środkami terapeutycznymi, istnieje potrzeba zarówno nadzoru, jak i ulepszonych środków terapeutycznych przeciwko krążącym wirusom podobnym do SARS. Nasze podejście odblokowuje także wykorzystanie danych metagenomicznych do przewidywania pojawienia się wirusa i zastosowania tej wiedzy w przygotowaniu do leczenia przyszłych infekcji wirusowych.
Metody
Wirusy, komórki, infekcja in vitro i testy łysinkowe.
SARS-CoV typu dzikiego (Urbani), SARS-CoV dostosowany do myszy i MAV chimeryczny podobny do SARS hodowano na komórkach Vero E6 (uzyskanych z Instytutu Badań Chorób Zakaźnych Stanów Zjednoczonych), hodowanych w zmodyfikowanym przez Dulbecco orle pożywka (DMEM) (Gibco, CA) i 5% surowica klonu płodowego (FCS) (Hyclone, South Logan, UT) wraz z antybiotykiem / środkiem przeciwgrzybiczym (Gibco, Carlsbad, CA). Komórki DBT (laboratorium Barica, nieznane źródło) wyrażające ortologi ACE2 zostały wcześniej opisane zarówno dla ludzi, jak i cywetów; sekwencja nietoperza Ace2 była oparta na sekwencji z Rhinolophus leschenaulti , a komórki DBT wyrażające nietoperz Ace2 ustalono jak opisano wcześniej 8. Eksperymenty z pseudotypowaniem były podobne do tych z użyciem pseudowirusa opartego na HIV, przygotowanego jak opisano wcześniej 10 i zbadanego na komórkach HeLa (Wuhan Institute of Virology), które wyrażały ortologi ACE2 . Komórki HeLa hodowano w minimalnej niezbędnej pożywce (MEM) (Gibco, CA) uzupełnionej 10% FCS (Gibco, CA), jak opisano wcześniej 24 . Krzywe wzrostu w komórkach nabłonka Vero E6, DBT, Calu-3 2B4 i pierwotnych ludzkich drogach oddechowych przeprowadzono zgodnie z wcześniejszym opisem 8 , 25. Żaden z działających zapasów linii komórkowych nie został ostatnio uwierzytelniony ani przetestowany pod kątem mykoplazm, chociaż oryginalne zapasy nasion użyte do wytworzenia zapasów roboczych nie są zanieczyszczone. Ludzkie płuca do hodowli HAE pobrano na Uniwersytecie Północnej Karoliny w protokołach zatwierdzonych przez Chapel Hill Institutional Review Board. Kultury HAE reprezentują wysoce zróżnicowany ludzki nabłonek dróg oddechowych zawierający rzęsiste i nieprzęsione komórki nabłonkowe, a także komórki kubkowe. Hodowle hoduje się również na granicy faz powietrze-ciecz przez kilka tygodni przed użyciem, jak opisano wcześniej 26. W skrócie, komórki przemyto PBS i zaszczepiono wirusem lub próbnie rozcieńczono w PBS przez 40 minut w 37 ° C. Po zaszczepieniu komórki przemyto trzy razy i dodano świeżą pożywkę, aby oznaczyć czas „0”. Trzy lub więcej powtórzeń biologicznych zebrano w każdym opisanym punkcie czasowym. W żadnym zbiorze próbek nie zastosowano ślepoty, a próbki nie były randomizowane. Całą hodowlę wirusa przeprowadzono w laboratorium na poziomie bezpieczeństwa biologicznego (BSL) 3 ze zbędnymi wentylatorami w szafkach na bezpieczeństwo biologiczne, jak opisano wcześniej przez naszą grupę 2 . Wszyscy pracownicy nosili zasilane respiratory oczyszczające powietrze (Breathe Easy, 3M) w kombinezonach, fartuchach i botkach Tyvek i mieli podwójne rękawiczki.
Grupowanie sekwencji i modelowanie strukturalne.
Pełnej długości sekwencje genomowe i sekwencje aminokwasowe domen S1 piku reprezentatywnych CoV pobrano z Genbank lub Pathosystems Resource Integration Center (PATRIC), zrównano z ClustalX i porównano filogenetycznie przy użyciu oszacowania maksymalnego prawdopodobieństwa przy użyciu 100 ładowań początkowych lub za pomocą PhyML ( https://code.google.com/p/phyml/) odpowiednio. Drzewo zostało wygenerowane przy użyciu maksymalnego prawdopodobieństwa z pakietem PhyML. Pasek skali reprezentuje podstawienia nukleotydów. Tylko węzły z obsługą ładowania początkowego powyżej 70% są oznaczone. Drzewo pokazuje, że CoV są podzielone na trzy odrębne grupy filogenetyczne zdefiniowane jako α-CoV, β-CoV i γ-CoV. Klasyczne klastry podgrup są oznaczone jako 2a, 2b, 2c i 2d dla β-CoV oraz 1a i 1b dla α-CoV. Modele strukturalne zostały wygenerowane przy użyciu Modeller (Max Planck Institute Bioinformatics Toolkit) w celu wygenerowania modeli homologii dla SHC014 i Rs3367 SARS RBD w kompleksie z ACE2 opartym na strukturze krystalicznej 2AJF (Protein Data Bank). Modele homologii zostały zwizualizowane i zmanipulowane w MacPyMol (wersja 1.3).
Konstrukcja chimerycznych wirusów podobnych do SARS.
Zarówno wirusy typu dzikiego, jak i chimeryczne pochodziły z SARS-CoV Urbani lub odpowiedniego dostosowanego do myszy zakaźnego klonu (SARS-CoV MA15), jak opisano wcześniej 27 . Plazmidy zawierające sekwencje szczytowe dla SHC014 ekstrahowano przez trawienie restrykcyjne i ligowano z plazmidem E i F zakaźnego klonu MA15. Klon został zaprojektowany i zakupiony w Bio Basic jako sześć ciągłych cDNA przy użyciu opublikowanych sekwencji flankowanych przez unikalne miejsca endonukleazy restrykcyjnej klasy II (BglI). Następnie plazmidy zawierające chimeryczne fragmenty genomu SARS-CoV i SHC014-CoV typu dzikiego powielono, wycięto, poddano ligacji i oczyszczono. Następnie przeprowadzono reakcje transkrypcji in vitro w celu syntezy genomowego RNA pełnej długości, który został transfekowany do komórek Vero E6, jak opisano wcześniej2 . Pożywkę z transfekowanych komórek zebrano i podano jako zapasy nasion do kolejnych eksperymentów. Wirusy chimeryczne i pełnej długości zostały potwierdzone przez analizę sekwencji przed użyciem w tych badaniach. Syntetyczna konstrukcja chimerycznego mutanta i pełnej długości SHC014-CoV została zatwierdzona przez Komitet ds. Bezpieczeństwa biologicznego na Uniwersytecie Północnej Karoliny oraz komitet ds. Badań nad podwójnym zastosowaniem badań.
Oświadczenie o etyce.
Badanie to zostało przeprowadzone zgodnie z zaleceniami dotyczącymi opieki i wykorzystania zwierząt przez Urząd ds. Dobrostanu Zwierząt Laboratoryjnych (OLAW), NIH. Komitet Instytucjonalnej Opieki nad Zwierzętami i Wykorzystaniem (IACUC) Uniwersytetu Karoliny Północnej w Chapel Hill (UNC, numer pozwolenia A-3410-01) zatwierdził protokół badań na zwierzętach (IACUC nr 13-033) zastosowany w tych badaniach.
Zakażenie myszy i in vivo .
Samice, 10-tygodniowe i 12-miesięczne myszy BALB / cAnNHsD zamówiono w Harlan Laboratories. Zakażenia myszy przeprowadzono zgodnie z wcześniejszym opisem 20. W skrócie, zwierzęta wprowadzono do laboratorium BSL3 i pozwolono na aklimatyzację przez 1 tydzień przed zakażeniem. W celu zakażenia i szczepienia żywym atenuowanym wirusem myszy znieczulono mieszaniną ketaminy i ksylazyny i zainfekowano donosowo, po prowokacji, 50 μl soli fizjologicznej buforowanej fosforanem (PBS) lub rozcieńczonym wirusem za pomocą trzech lub czterech myszy na punkt czasowy, na grupa zakażeń na dawkę, jak opisano w legendach rysunków. W przypadku pojedynczych myszy oznaczenia infekcji, w tym nie wdychania całej dawki, bulgotania inokulum z nosa lub infekcji przez usta, mogły według uznania badacza wykluczyć dane myszy; po zakażeniu nie zdefiniowano innych wcześniej ustalonych kryteriów wykluczenia lub włączenia. W żadnym doświadczeniu na zwierzętach nie zastosowano zaślepienia, a zwierzęta nie były randomizowane. Do szczepienia młode i starzejące się myszy zostały zaszczepione przez wstrzyknięcie poduszek poduszkowych o objętości 20 μl albo 0,2 μg podwójnie inaktywowanej szczepionki SARS-CoV z ałunem lub pozornym PBS; myszy następnie wzmacniano tym samym schematem 22 dni później i prowokowano 21 dni później. Dla wszystkich grup, zgodnie z protokołem, zwierzęta monitorowano codziennie pod kątem klinicznych objawów choroby (przeczucie, potargane futro i zmniejszona aktywność) przez czas trwania doświadczenia. Utratę masy monitorowano codziennie przez pierwsze 7 dni, po czym kontynuowano monitorowanie masy, aż zwierzęta powróciły do początkowej masy początkowej lub wykazywały stały wzrost masy przez 3 dni. Wszystkie myszy, które straciły ponad 20% swojej początkowej masy ciała, były karmione gruntem i dalej monitorowane wiele razy dziennie, o ile były poniżej 20% wartości granicznej. Myszy, które straciły ponad 30% początkowej masy ciała, natychmiast uśmiercano zgodnie z protokołem. Każda mysz uznana za konającą lub mało prawdopodobną do odzyskania również została humanitarnie poświęcona według uznania badacza. Eutanazję przeprowadzono przedawkowaniem izofluranu, a śmierć potwierdzono zwichnięciem szyjki macicy. Wszystkie badania na myszach przeprowadzono na University of North Carolina (Animal Welfare Assurance # A3410-01) przy użyciu protokołów zatwierdzonych przez Komitet Opieki i Użytkowania Zwierząt UNC (IACUC).
Analiza histologiczna.
Lewe płuco usunięto i zanurzono w 10% buforowanej formalinie (Fisher) bez inflacji przez 1 tydzień. Tkanki zatopiono w parafinie i 5-μm skrawki przygotowano w głównym ośrodku histopatologicznym UNC Lineberger Comprehensive Cancer Center. Aby określić stopień barwienia antygenu, skrawki barwiono na antygen wirusowy przy użyciu dostępnego w handlu poliklonalnego przeciwciała przeciw nukleokapsydowi SARS-CoV (Imgenex) i oceniano w sposób zaślepiony przez barwienie dróg oddechowych i miąższu, jak opisano wcześniej 20 . Obrazy zostały wykonane przy użyciu mikroskopu Olympus BX41 za pomocą aparatu Olympus DP71.
Testy neutralizacji wirusa.
Testy miana neutralizacji redukcji płytki nazębnej przeprowadzono z uprzednio scharakteryzowanymi przeciwciałami przeciw SARS-CoV, jak opisano wcześniej 11 , 12 , 13 . W skrócie, neutralizujące przeciwciała lub surowicę seryjnie rozcieńczono dwukrotnie i inkubowano ze 100 pfu różnych zakaźnych szczepów SARS-CoV przez 1 godzinę w 37 ° C. Wirus i przeciwciała dodano do płytki 6-studzienkowej przy 5 x 10 5 komórek Vero E6 / oraz z wielu powtórzeń ( n ≥ 2). Po 1-godzinnej inkubacji w 37 ° C komórki pokryto 3 ml 0,8% agarozy w pożywce. Płytki inkubowano przez 2 dni w 37 ° C, wybarwiono neutralną czerwienią przez 3 godziny i zliczono łysinki. Procent zmniejszenia liczby łysinek obliczono jako (1 - (liczba łysinek z przeciwciałem / liczba łysinek bez przeciwciał)) × 100.
Analiza statystyczna.
Wszystkie eksperymenty przeprowadzono kontrastując dwie grupy eksperymentalne (albo dwa wirusy, albo kohorty szczepione i nieszczepione). Dlatego znaczące różnice w mianie wirusa i punktacji histologicznej zostały określone przez dwustronny test t Studenta w poszczególnych punktach czasowych. Dane były zwykle dystrybuowane w każdej porównywanej grupie i miały podobną wariancję.
Bezpieczeństwo biologiczne i bezpieczeństwo biologiczne.
Zgłoszone badania zostały zainicjowane po zatwierdzeniu protokołu eksperymentalnego przez Komitet ds. Bezpieczeństwa Biologicznego Uniwersytetu Północnej Karoliny (Tytuł projektu: Generowanie zakaźnych klonów CoVsopodobnych nietoperzy; Lab Safety Plan ID: 20145741; Schedule G ID: 12279). Badania te zostały zainicjowane przed przerwą w finansowaniu rządowych badań naukowych nad pauzą dotyczącą wybranych badań nad zyskiem funkcji obejmujących wirusy grypy, MERS i SARS ( http://www.phe.gov/s3/dualuse/Documents/gain-of-function .pdf ). Dokument ten został przejrzany przez agencję finansującą, NIH. Poproszono o kontynuację tych badań, co zostało zatwierdzone przez NIH.
SARS-CoV is a select agent. All work for these studies was performed with approved standard operating procedures (SOPs) and safety conditions for SARS-CoV, MERs-CoV and other related CoVs. Our institutional CoV BSL3 facilities have been designed to conform to the safety requirements that are recommended in the Biosafety in Microbiological and Biomedical Laboratories (BMBL), the US Department of Health and Human Services, the Public Health Service, the Centers for Disease Control (CDC) and the NIH. Laboratory safety plans were submitted to, and the facility has been approved for use by, the UNC Department of Environmental Health and Safety (EHS) and the CDC. Electronic card access is required for entry into the facility. All workers have been trained by EHS to safely use powered air purifying respirators (PAPRs), and appropriate work habits in a BSL3 facility and active medical surveillance plans are in place. Our CoV BSL3 facilities contain redundant fans, emergency power to fans and biological safety cabinets and freezers, and our facilities can accommodate SealSafe mouse racks. Materials classified as BSL3 agents consist of SARS-CoV, bat CoV precursor strains, MERS-CoV and mutants derived from these pathogens. Within the BSL3 facilities, experimentation with infectious virus is performed in a certified Class II Biosafety Cabinet (BSC). All members of the staff wear scrubs, Tyvek suits and aprons, PAPRs and shoe covers, and their hands are double-gloved. BSL3 users are subject to a medical surveillance plan monitored by the University Employee Occupational Health Clinic (UEOHC), which includes a yearly physical, annual influenza vaccination and mandatory reporting of any symptoms associated with CoV infection during periods when working in the BSL3. All BSL3 users are trained in exposure management and reporting protocols, are prepared to self-quarantine and have been trained for safe delivery to a local infectious disease management department in an emergency situation. All potential exposure events are reported and investigated by EHS and UEOHC, with reports filed to both the CDC and the NIH.
Kody dostępu Przystąpienia
Bank danych białek
- 2AJF
Zmieniać historię
20 listopada 2015 r
W wersji tego artykułu, pierwotnie opublikowanej online, autorzy pominęli uznanie źródła finansowania, finansowania USAID-EPT-PREDICT od EcoHealth Alliance, do Z.-LS Błąd został poprawiony dla wersji drukowanej, PDF i HTML tego artykułu .
Bibliografia
-
1
Ge, XY i in. Izolacja i charakterystyka koronawirusa nietoperza podobnego do SARS, który wykorzystuje receptor ACE2. Nature 503 , 535–538 (2013).
-
CAS
-
Artykuł
-
Google Scholar
-
-
2)
Yount, B. i in. Odwrotna genetyka z pełnej długości zakaźnym cDNA koronawirusa zespołu ostrej niewydolności oddechowej. Proc. Natl. Acad Sci. USA 100 , 12995–13000 (2003).
-
CAS
-
Artykuł
-
Google Scholar
-
-
3)
Becker, MM i in. Syntetyczny rekombinowany koronawirus SARS podobny do nietoperza jest zakaźny w hodowanych komórkach i myszach. Proc. Natl. Acad Sci. USA 105 , 19944–19949 (2008).
-
CAS
-
Artykuł
-
Google Scholar
-
-
4
Peiris, JS, Guan, Y. i Yuen, KY Zespół ciężkiego ostrego układu oddechowego. Nat. Med. 10 , S88 – S97 (2004).
-
CAS
-
Artykuł
-
Google Scholar
-
-
5
Al-Tawfiq, JA i in. Nadzór nad nowymi wirusami układu oddechowego. Lancet Infect. Dis. 14 , 992–1000 (2014).
-
Artykuł
-
Google Scholar
-
-
6
On, B. i in. Identyfikacja różnych alfakoronawirusów i charakterystyka genomowa nowego ostrego zespołu ostrego układu oddechowego, podobnego do koronawirusa od nietoperzy w Chinach. J. Virol. 88 , 7070–7082 (2014).
-
Artykuł
-
Google Scholar
-
-
7
Li, F. Rozpoznanie receptora i zakażenia międzygatunkowe koronawirusa SARS. Antiviral Res. 100 , 246–254 (2013).
-
CAS
-
Artykuł
-
Google Scholar
-
-
8
Sheahan, T. i in. Mechanizmy rozszerzania się zasięgu gospodarza koronawirusa zoonotycznego ciężkiego ostrego zespołu oddechowego w nabłonku ludzkich dróg oddechowych. J. Virol. 82 , 2274–2285 (2008).
- CAS
- Artykuł
- Google Scholar
- 9
Yoshikawa, T. i in. Dynamiczne wrodzone odpowiedzi immunologiczne ludzkich komórek nabłonka oskrzeli na ciężkie zakażenie koronawirusem związane z ostrym zespołem oddechowym. PLoS ONE 5 , e8729 (2010).
- Artykuł
- Google Scholar
- 10
Qiu, X. i in. Odwrócenie zaawansowanej choroby wirusa Ebola u zwierząt z rzędu naczelnych za pomocą ZMapp. Nature 514 , 47–53 (2014).
- CAS
- Artykuł
- Google Scholar
- 11
Sui, J. i in. Poszerzenie aktywności neutralizacyjnej w celu bezpośredniego blokowania szlaku ewolucji koronawirusa SARS kierowanego przez przeciwciała. PLoS Pathog. 4 , e1000197 (2008).
- Artykuł
- Google Scholar
- 12
Sui, J. i in. Wpływ ludzkich przeciwciał w domenie wiążących receptor anty-skokowy białka na ciężki ostry zespół oddechowy neutralizacja koronawirusa ucieczka i sprawność fizyczna. J. Virol. 88 , 13769–13780 (2014).
- Artykuł
- Google Scholar
- 13
Rockx, B. i in. Ucieczka od neutralizacji ludzkich przeciwciał monoklonalnych wpływa na sprawność koronawirusa zespołu ostrego ostrego zespołu oddechowego in vitro i in vivo . J. Infect. Dis. 201 , 946–955 (2010).
- CAS
- Artykuł
- Google Scholar
- 14
Spruth, M. i in. Podwójnie inaktywowana szczepionka koronawirusowa SARS będąca kandydatem na całego wirusa stymuluje neutralizujące i ochronne odpowiedzi przeciwciał. Vaccine 24 , 652–661 (2006).
- CAS
- Artykuł
- Google Scholar
- 15
Bolles, M. i in. Szczepionka przeciw koronawirusowi na ostry zespół podwójnie inaktywowanego ostrego układu oddechowego zapewnia niepełną ochronę u myszy i indukuje zwiększoną eozynofilową prozapalną odpowiedź płucną po prowokacji. J. Virol. 85 , 12201–12215 (2011).
- CAS
- Artykuł
- Google Scholar
- 16
Siegrist, C.-A. in Vaccines 6th edn. (red. Plotkin, SA, Orenstein, WA & Offit, PA) 14–32 (WB Saunders, 2013).
- 17
Deming, D. i in. Skuteczność szczepionki u starzejących się myszy poddanych prowokacji rekombinowanym SARS-CoV niosącym epidemię i zoonotyczne warianty kolców. PLoS Med. 3 , e525 (2006).
- Artykuł
- Google Scholar
- 18
Graham, RL, Donaldson, EF i Baric, RS Dziesięć lat po SARS: strategie kontrolowania pojawiających się koronawirusów. Nat. Rev Microbiol. 11 , 836–848 (2013).
- CAS
- Artykuł
- Google Scholar
- 19
Graham, RL i Baric, rekombinacja RS, zbiorniki i modułowy skok: mechanizmy przenoszenia międzygatunkowego koronawirusa. J. Virol. 84 , 3134–3146 (2010).
- CAS
- Artykuł
- Google Scholar
- 20
Agnihothram, S. i in. Model myszy dla podgrupy 2c betakoronawirusa przy użyciu wariantu HKU5 koronawirusa nietoperza. MBio 5 , e00047-14 (2014).
- Artykuł
- Google Scholar
- 21
Relman, DA Metagenomika, diagnostyka chorób zakaźnych i badania epidemii: najpierw sekwencja, później pytania? J. Am. Med. Dr hab. 309 , 1531–1532 (2013).
- CAS
- Artykuł
- Google Scholar
- 22
Kaiser, J. Moratorium na ryzykowne studia wirusologiczne pozostawia pracę w 14 instytucjach w zawieszeniu. ScienceInsider http://news.sciencemag.org/biology/2014/11/moratorium-risky-virology-studies-leaves-work-14-institutions-limbo (2014).
- 23
Frieman, M. i in. Molekularne uwarunkowania ciężkiego ostrego zespołu oddechowego patogenezy koronawirusa i wirulencji u młodych i starszych modeli myszy u ludzi. J. Virol. 86 , 884–897 (2012).
- CAS
- Artykuł
- Google Scholar
- 24
Ren, W. i in. Różnica w użyciu receptora między koronawirusem ciężkiego ostrego zespołu oddechowego (SARS) a koronawirusem SARS-podobnym pochodzącym od nietoperzy. J. Virol. 82 , 1899–1907 (2008).
- CAS
- Artykuł
- Google Scholar
- 25
Sims, AC i in. Uwolnienie ostrego zespołu ostrego zespołu oddechowego blok koronawirusa importu jądrowego poprawia transkrypcję gospodarza w ludzkich komórkach płuc. J. Virol. 87 , 3885–3902 (2013).
- CAS
- Artykuł
- Google Scholar
- 26
Fulcher, ML, Gabriel, S., Burns, KA, Yankaskas, JR & Randell, SH Dobrze zróżnicowane hodowle komórek nabłonkowych ludzkich dróg oddechowych. Methods Mol. Med. 107 , 183–206 (2005).
- CAS
- PubMed
- Google Scholar
- 27
Roberts, A. i in. Dostosowany do myszy koronawirus SARS powoduje choroby i śmiertelność u myszy BALB / c. PLoS Pathog. 3 , e5.
- Artykuł
- Google Scholar
Pobierz referencje
Podziękowanie
Badania w tym manuskrypcie były wspierane przez granty z National Institute of Allergy & Infectious Disease i National Institute of Aging z US National Institutes of Health (NIH) w ramach nagród U19AI109761 (RSB), U19AI107810 (RSB), AI085524 (WAM), F32AI102561 (VDM) i K99AG049092 (VDM) oraz przez National Natural Science Foundation of China przyznaje nagrody 81290341 (Z.-LS) i 31470260 (X.-YG), a także finansowanie USAID-EPT-PREDICT z EcoHealth Alliance (Z. -LS). Kultury nabłonkowe ludzkich dróg oddechowych były wspierane przez National Institute of Diabetes and Digestive and Kidney Disease of NIH w ramach nagrody NIH DK065988 (SHR). Dziękujemy również MT Ferris (Wydział Genetyki, Uniwersytet Północnej Karoliny) za przegląd podejść statystycznych i CT Tseng (Departament Mikrobiologii i Immunologii, University of Texas Medical Branch) za dostarczenie komórek Calu-3. Eksperymenty z pełnowymiarowymi i chimerycznymi rekombinowanymi wirusami SHC014 zostały zainicjowane i przeprowadzone przed wstrzymaniem finansowania badań GOF i od tego czasu zostały przejrzane i zatwierdzone do dalszych badań przez NIH. Treść należy wyłącznie do autorów i niekoniecznie reprezentuje oficjalne poglądy NIH.
Informacje o autorze
Przynależność
- Wydział Epidemiologii, Uniwersytet Karoliny Północnej w Chapel Hill, Chapel Hill, Karolina Północna, USA
- Vineet D Menachery
- , Boyd L. Yount Jr
- , Kari Debbink
- , Lisa E. Graliński
- , Jessica A Plante
- , Rachel L. Graham
- , Trevor Scobey
- , Eric F. Donaldson
- I Ralph S. Baric
- Katedra Mikrobiologii i Immunologii, Uniwersytet Karoliny Północnej w Chapel Hill, Chapel Hill, Karolina Północna, USA
- Kari Debbink
- I Ralph S. Baric
- National Center for Toxicological Research, Food and Drug Administration, Jefferson, Arkansas, USA
- Sudhakar Agnihothram
- Kluczowe laboratorium specjalnych patogenów i bezpieczeństwa biologicznego, Wuhan Institute of Virology, Chińska Akademia Nauk, Wuhan, Chiny
- Xing-Yi Ge
- I Zhengli-Li Shi
- Wydział Biologii Komórki i Fizjologii, Uniwersytet Karoliny Północnej w Chapel Hill, Chapel Hill, Karolina Północna, USA
- Scott H Randell
- Cystic Fibrosis Center, Marsico Lung Institute, University of North Carolina at Chapel Hill, Chapel Hill, Karolina Północna, USA
- Scott H Randell
- Instytut Badań Biomedycznych, Bellinzona Institute of Microbiology, Zurych, Szwajcaria
- Antonio Lanzavecchia
- Department of Cancer Immunology and AIDS, Dana-Farber Cancer Institute, Harvard Medical School, Boston, Massachusetts, USA
- Wayne A Marasco
- Department of Medicine, Harvard Medical School, Boston, Massachusetts, USA
- Wayne A Marasco
Składki
VDM zaprojektował, skoordynował i przeprowadził eksperymenty, ukończył analizę i napisał manuskrypt. BLY zaprojektował zakaźnego klon i odzyskał chimeryczne wirusy; SA zakończyła testy neutralizacji; LEG pomógł przeprowadzić eksperymenty na myszach; TS i JAP zakończyli eksperymenty na myszach i testy łysinkowe; X.-YG przeprowadził eksperymenty z pseudotypowaniem; KD wygenerował dane strukturalne i prognozy; Wygenerowana przez EFD analiza filogenetyczna; RLG zakończyło analizę RNA; SHR zapewnił pierwotne kultury HAE; AL i WAM dostarczyły krytyczne odczynniki przeciwciał monoklonalnych; a Z.-LS dostarczył sekwencje pików i plazmidy SHC014. RSB zaprojektował eksperymenty i napisał manuskrypt.
Autorzy korespondenci
Korespondencja z Vineache D Menachery lub Ralph S Baric .
Deklaracje etyczne
Konkurencyjne interesy
Autorzy deklarują brak konkurujących interesów finansowych.
Dodatkowa informacja
Tekst uzupełniający i ryciny
Rysunki uzupełniające 1–6 i tabele uzupełniające 1–4 (PDF 4747 kb)
Prawa i uprawnienia
O tym artykule
Cytuj ten artykuł
Menachery, V., Yount, B., Debbink, K. i in. Klaster krążących nietoperzy koronawirusów, podobny do SARS, pokazuje możliwość pojawienia się człowieka. Nat Med 21, 1508–1513 (2015). https://doi.org/10.1038/nm.3985
- Odebrane
- Przyjęty
- Opublikowany
- Data wydania
- DOI https://doi.org/10.1038/nm.3985
Udostępnij ten artykuł
Każda osoba, której udostępnisz poniższy link, będzie mogła przeczytać tę treść:
Duff dużo podróżował, jest publikowany na całym świecie i regularnie gości w telewizji i radiu w więcej niż „kilku” krajach. Jest także wyszkolonym szefem kuchni, miłośnikiem wina, zapalonym motocyklistą i rusznikarzem specjalizującym się w broni historycznej i restauracjach. Doświadczenia biznesowe i zainteresowania dotyczą technologii energii i obrony.
Gordon's Archives - 2008-2014
Original 2015 research unedited and complete
A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence
- Published:
- https://www.nature.com/articles/nm.3985
- Vineet D Menachery,
- Boyd L Yount Jr,
- Kari Debbink,
- Sudhakar Agnihothram,
- Lisa E Gralinski,
- Jessica A Plante,
- Rachel L Graham,
- Trevor Scobey,
- Xing-Yi Ge,
- Eric F Donaldson,
- Scott H Randell,
- Antonio Lanzavecchia,
- Wayne A Marasco,
- Zhengli-Li Shi &
- Ralph S Baric
Nature Medicine volume 21, pages1508–1513(2015)Cite this article
-
1.05m Accesses
-
94 Citations
-
6156 Altmetric
- A Corrigendum to this article was published on 06 April 2016
Abstract
The emergence of severe acute respiratory syndrome coronavirus (SARS-CoV) and Middle East respiratory syndrome (MERS)-CoV underscores the threat of cross-species transmission events leading to outbreaks in humans. Here we examine the disease potential of a SARS-like virus, SHC014-CoV, which is currently circulating in Chinese horseshoe bat populations1. Using the SARS-CoV reverse genetics system2, we generated and characterized a chimeric virus expressing the spike of bat coronavirus SHC014 in a mouse-adapted SARS-CoV backbone. The results indicate that group 2b viruses encoding the SHC014 spike in a wild-type backbone can efficiently use multiple orthologs of the SARS receptor human angiotensin converting enzyme II (ACE2), replicate efficiently in primary human airway cells and achieve in vitro titers equivalent to epidemic strains of SARS-CoV. Additionally, in vivo experiments demonstrate replication of the chimeric virus in mouse lung with notable pathogenesis. Evaluation of available SARS-based immune-therapeutic and prophylactic modalities revealed poor efficacy; both monoclonal antibody and vaccine approaches failed to neutralize and protect from infection with CoVs using the novel spike protein. On the basis of these findings, we synthetically re-derived an infectious full-length SHC014 recombinant virus and demonstrate robust viral replication both in vitro and in vivo. Our work suggests a potential risk of SARS-CoV re-emergence from viruses currently circulating in bat populations.
Main
The emergence of SARS-CoV heralded a new era in the cross-species transmission of severe respiratory illness with globalization leading to rapid spread around the world and massive economic impact3,4. Since then, several strains—including influenza A strains H5N1, H1N1 and H7N9 and MERS-CoV—have emerged from animal populations, causing considerable disease, mortality and economic hardship for the afflicted regions5. Although public health measures were able to stop the SARS-CoV outbreak4, recent metagenomics studies have identified sequences of closely related SARS-like viruses circulating in Chinese bat populations that may pose a future threat1,6. However, sequence data alone provides minimal insights to identify and prepare for future prepandemic viruses. Therefore, to examine the emergence potential (that is, the potential to infect humans) of circulating bat CoVs, we built a chimeric virus encoding a novel, zoonotic CoV spike protein—from the RsSHC014-CoV sequence that was isolated from Chinese horseshoe bats1—in the context of the SARS-CoV mouse-adapted backbone. The hybrid virus allowed us to evaluate the ability of the novel spike protein to cause disease independently of other necessary adaptive mutations in its natural backbone. Using this approach, we characterized CoV infection mediated by the SHC014 spike protein in primary human airway cells and in vivo, and tested the efficacy of available immune therapeutics against SHC014-CoV. Together, the strategy translates metagenomics data to help predict and prepare for future emergent viruses.
The sequences of SHC014 and the related RsWIV1-CoV show that these CoVs are the closest relatives to the epidemic SARS-CoV strains (Fig. 1a,b); however, there are important differences in the 14 residues that bind human ACE2, the receptor for SARS-CoV, including the five that are critical for host range: Y442, L472, N479, T487 and Y491 (ref. 7). In WIV1, three of these residues vary from the epidemic SARS-CoV Urbani strain, but they were not expected to alter binding to ACE2 (Supplementary Fig. 1a,b and Supplementary Table 1). This fact is confirmed by both pseudotyping experiments that measured the ability of lentiviruses encoding WIV1 spike proteins to enter cells expressing human ACE2 (Supplementary Fig. 1) and by in vitro replication assays of WIV1-CoV (ref. 1). In contrast, 7 of 14 ACE2-interaction residues in SHC014 are different from those in SARS-CoV, including all five residues critical for host range (Supplementary Fig. 1c and Supplementary Table 1). These changes, coupled with the failure of pseudotyped lentiviruses expressing the SHC014 spike to enter cells (Supplementary Fig. 1d), suggested that the SHC014 spike is unable to bind human ACE2. However, similar changes in related SARS-CoV strains had been reported to allow ACE2 binding7,8, suggesting that additional functional testing was required for verification. Therefore, we synthesized the SHC014 spike in the context of the replication-competent, mouse-adapted SARS-CoV backbone (we hereafter refer to the chimeric CoV as SHC014-MA15) to maximize the opportunity for pathogenesis and vaccine studies in mice (Supplementary Fig. 2a). Despite predictions from both structure-based modeling and pseudotyping experiments, SHC014-MA15 was viable and replicated to high titers in Vero cells (Supplementary Fig. 2b). Similarly to SARS, SHC014-MA15 also required a functional ACE2 molecule for entry and could use human, civet and bat ACE2 orthologs (Supplementary Fig. 2c,d). To test the ability of the SHC014 spike to mediate infection of the human airway, we examined the sensitivity of the human epithelial airway cell line Calu-3 2B4 (ref. 9) to infection and found robust SHC014-MA15 replication, comparable to that of SARS-CoV Urbani (Fig. 1c). To extend these findings, primary human airway epithelial (HAE) cultures were infected and showed robust replication of both viruses (Fig. 1d). Together, the data confirm the ability of viruses with the SHC014 spike to infect human airway cells and underscore the potential threat of cross-species transmission of SHC014-CoV.
(a) The full-length genome sequences of representative CoVs were aligned and phylogenetically mapped as described in the Online Methods. The scale bar represents nucleotide substitutions, with only bootstrap support above 70% being labeled. The tree shows CoVs divided into three distinct phylogenetic groups, defined as α-CoVs, β-CoVs and γ-CoVs. Classical subgroup clusters are marked as 2a, 2b, 2c and 2d for the β-CoVs and as 1a and 1b for the α-CoVs. (b) Amino acid sequences of the S1 domains of the spikes of representative β-CoVs of the 2b group, including SARS-CoV, were aligned and phylogenetically mapped. The scale bar represents amino acid substitutions. (c,d) Viral replication of SARS-CoV Urbani (black) and SHC014-MA15 (green) after infection of Calu-3 2B4 cells (c) or well-differentiated, primary air-liquid interface HAE cell cultures (d) at a multiplicity of infection (MOI) of 0.01 for both cell types. Samples were collected at individual time points with biological replicates (n = 3) for both Calu-3 and HAE experiments. (e,f) Weight loss (n = 9 for SARS-CoV MA15; n = 16 for SHC014-MA15) (e) and viral replication in the lungs (n = 3 for SARS-CoV MA15; n = 4 for SHC014-MA15) (f) of 10-week-old BALB/c mice infected with 1 × 104 p.f.u. of mouse-adapted SARS-CoV MA15 (black) or SHC014-MA15 (green) via the intranasal (i.n.) route. (g,h) Representative images of lung sections stained for SARS-CoV N antigen from mice infected with SARS-CoV MA15 (n = 3 mice) (g) or SHC014-MA15 (n = 4 mice) (h) are shown. For each graph, the center value represents the group mean, and the error bars define the s.e.m. Scale bars, 1 mm.
To evaluate the role of the SHC014 spike in mediating infection in vivo, we infected 10-week-old BALB/c mice with 104 plaque-forming units (p.f.u.) of either SARS-MA15 or SHC014-MA15 (Fig. 1e–h). Animals infected with SARS-MA15 experienced rapid weight loss and lethality by 4 d post infection (d.p.i.); in contrast, SHC014-MA15 infection produced substantial weight loss (10%) but no lethality in mice (Fig. 1e). Examination of viral replication revealed nearly equivalent viral titers from the lungs of mice infected with SARS-MA15 or SHC014-MA15 (Fig. 1f). Whereas lungs from the SARS-MA15–infected mice showed robust staining in both the terminal bronchioles and the lung parenchyma 2 d.p.i. (Fig. 1g), those of SHC014-MA15–infected mice showed reduced airway antigen staining (Fig. 1h); in contrast, no deficit in antigen staining was observed in the parenchyma or in the overall histology scoring, suggesting differential infection of lung tissue for SHC014-MA15 (Supplementary Table 2). We next analyzed infection in more susceptible, aged (12-month-old) animals. SARS-MA15–infected animals rapidly lost weight and succumbed to infection (Supplementary Fig. 3a,b). SHC014-MA15 infection induced robust and sustained weight loss, but had minimal lethality. Trends in the histology and antigen staining patterns that we observed in young mice were conserved in the older animals (Supplementary Table 3). We excluded the possibility that SHC014-MA15 was mediating infection through an alternative receptor on the basis of experiments using Ace2−/− mice, which did not show weight loss or antigen staining after SHC014-MA15 infection (Supplementary Fig. 4a,b and Supplementary Table 2). Together, the data indicate that viruses with the SHC014 spike are capable of inducing weight loss in mice in the context of a virulent CoV backbone.
Given the preclinical efficacy of Ebola monoclonal antibody therapies, such as ZMApp10, we next sought to determine the efficacy of SARS-CoV monoclonal antibodies against infection with SHC014-MA15. Four broadly neutralizing human monoclonal antibodies targeting SARS-CoV spike protein had been previously reported and are probable reagents for immunotherapy11,12,13. We examined the effect of these antibodies on viral replication (expressed as percentage inhibition of viral replication) and found that whereas wild-type SARS-CoV Urbani was strongly neutralized by all four antibodies at relatively low antibody concentrations (Fig. 2a–d), neutralization varied for SHC014-MA15. Fm6, an antibody generated by phage display and escape mutants11,12, achieved only background levels of inhibition of SHC014-MA15 replication (Fig. 2a). Similarly, antibodies 230.15 and 227.14, which were derived from memory B cells of SARS-CoV–infected patients13, also failed to block SHC014-MA15 replication (Fig. 2b,c). For all three antibodies, differences between the SARS and SHC014 spike amino acid sequences corresponded to direct or adjacent residue changes found in SARS-CoV escape mutants (fm6 N479R; 230.15 L443V; 227.14 K390Q/E), which probably explains the absence of the antibodies’ neutralizing activity against SHC014. Finally, monoclonal antibody 109.8 was able to achieve 50% neutralization of SHC014-MA15, but only at high concentrations (10 μg/ml) (Fig. 2d). Together, the results demonstrate that broadly neutralizing antibodies against SARS-CoV may only have marginal efficacy against emergent SARS-like CoV strains such as SHC014.
(a–d) Neutralization assays evaluating efficacy (measured as reduction in the number of plaques) of a panel of monoclonal antibodies, which were all originally generated against epidemic SARS-CoV, against infection of Vero cells with SARS-CoV Urbani (black) or SHC014-MA15 (green). The antibodies tested were fm6 (n = 3 for Urbani; n = 5 for SHC014-MA15)11,12 (a), 230.15 (n = 3 for Urbani; n = 2 for SHC014-MA15) (b), 227.15 (n = 3 for Urbani; n = 5 for SHC014-MA15) (c) and 109.8 (n = 3 for Urbani; n = 2 for SHC014-MA15)13 (d). Each data point represents the group mean and error bars define the s.e.m. Note that the error bars in SARS-CoV Urbani–infected Vero cells in b,c are overlapped by the symbols and are not visible.
To evaluate the efficacy of existing vaccines against infection with SHC014-MA15, we vaccinated aged mice with double-inactivated whole SARS-CoV (DIV). Previous work showed that DIV could neutralize and protect young mice from challenge with a homologous virus14; however, the vaccine failed to protect aged animals in which augmented immune pathology was also observed, indicating the possibility of the animals being harmed because of the vaccination15. Here we found that DIV did not provide protection from challenge with SHC014-MA15 with regards to weight loss or viral titer (Supplementary Fig. 5a,b). Consistent with a previous report with other heterologous group 2b CoVs15, serum from DIV-vaccinated, aged mice also failed to neutralize SHC014-MA15 (Supplementary Fig. 5c). Notably, DIV vaccination resulted in robust immune pathology (Supplementary Table 4) and eosinophilia (Supplementary Fig. 5d–f). Together, these results confirm that the DIV vaccine would not be protective against infection with SHC014 and could possibly augment disease in the aged vaccinated group.
In contrast to vaccination of mice with DIV, the use of SHC014-MA15 as a live, attenuated vaccine showed potential cross-protection against challenge with SARS-CoV, but the results have important caveats. We infected young mice with 104 p.f.u. of SHC014-MA15 and observed them for 28 d. We then challenged the mice with SARS-MA15 at day 29 (Supplementary Fig. 6a). The prior infection of the mice with the high dose of SHC014-MA15 conferred protection against challenge with a lethal dose of SARS-MA15, although there was only a minimal SARS-CoV neutralization response from the antisera elicited 28 d after SHC014-MA15 infection (Supplementary Fig. 6b, 1:200). In the absence of a secondary antigen boost, 28 d.p.i. represents the expected peak of antibody titers and implies that there will be diminished protection against SARS-CoV over time16,17. Similar results showing protection against challenge with a lethal dose of SARS-CoV were observed in aged BALB/c mice with respect to weight loss and viral replication (Supplementary Fig. 6c,d). However, the SHC014-MA15 infection dose of 104 p.f.u. induced >10% weight loss and lethality in some aged animals (Fig. 1 and Supplementary Fig. 3). We found that vaccination with a lower dose of SHC014-MA15 (100 p.f.u.), did not induce weight loss, but it also failed to protect aged animals from a SARS-MA15 lethal dose challenge (Supplementary Fig. 6e,f). Together, the data suggest that SHC014-MA15 challenge may confer cross-protection against SARS-CoV through conserved epitopes, but the required dose induces pathogenesis and precludes use as an attenuated vaccine.
Having established that the SHC014 spike has the ability to mediate infection of human cells and cause disease in mice, we next synthesized a full-length SHC014-CoV infectious clone based on the approach used for SARS-CoV (Fig. 3a)2. Replication in Vero cells revealed no deficit for SHC014-CoV relative to that for SARS-CoV (Fig. 3b); however, SHC014-CoV was significantly (P < 0.01) attenuated in primary HAE cultures at both 24 and 48 h after infection (Fig. 3c). In vivo infection of mice demonstrated no significant weight loss but showed reduced viral replication in lungs of full-length SHC014-CoV infection, as compared to SARS-CoV Urbani (Fig. 3d,e). Together, the results establish the viability of full-length SHC014-CoV, but suggest that further adaptation is required for its replication to be equivalent to that of epidemic SARS-CoV in human respiratory cells and in mice.
(a) Schematic of the SHC014-CoV molecular clone, which was synthesized as six contiguous cDNAs (designated SHC014A, SHC014B, SHC014C, SHC014D, SHC014E and SHC014F) flanked by unique BglI sites that allowed for directed assembly of the full-length cDNA expressing open reading frames (for 1a, 1b, spike, 3, envelope, matrix, 6–8 and nucleocapsid). Underlined nucleotides represent the overhang sequences formed after restriction enzyme cleavage. (b,c) Viral replication of SARS-CoV Urbani (black) or SHC014-CoV (green) after infection of Vero cells (b) or well-differentiated, primary air-liquid interface HAE cell cultures (c) at an MOI of 0.01. Samples were collected at individual time points with biological replicates (n = 3) for each group. Data represent one experiment for both Vero and HAE cells. (d,e) Weight loss (n = 3 for SARS-CoV MA15, n = 7 for SHC014-CoV; n = 6 for SARS-Urbani) (d) and viral replication in the lungs (n = 3 for SARS-Urbani and SHC014-CoV) (e) of 10-week-old BALB/c mice infected with 1 × 105 p.f.u. of SARS-CoV MA15 (gray), SHC014-CoV (green) or SARS-CoV Urbani (black) via the i.n. route. Each data point represents the group mean, and error bars define the s.e.m. **P < 0.01 and ***P < 0.001 using two-tailed Student’s t-test of individual time points.
During the SARS-CoV epidemic, links were quickly established between palm civets and the CoV strains that were detected in humans4. Building on this finding, the common emergence paradigm argues that epidemic SARS-CoV originated as a bat virus, jumped to civets and incorporated changes within the receptor-binding domain (RBD) to improve binding to civet Ace2 (ref. 18). Subsequent exposure to people in live-animal markets permitted human infection with the civet strain, which, in turn, adapted to become the epidemic strain (Fig. 4a). However, phylogenetic analysis suggests that early human SARS strains appear more closely related to bat strains than to civet strains18. Therefore, a second paradigm argues that direct bat-human transmission initiated SARS-CoV emergence and that palm civets served as a secondary host and reservoir for continued infection (Fig. 4b)19. For both paradigms, spike adaptation in a secondary host is seen as a necessity, with most mutations expected to occur within the RBD, thereby facilitating improved infection. Both theories imply that pools of bat CoVs are limited and that host-range mutations are both random and rare, reducing the likelihood of future emergence events in humans.
Coronavirus strains are maintained in quasi-species pools circulating in bat populations. (a,b) Traditional SARS-CoV emergence theories posit that host-range mutants (red circle) represent random and rare occurrences that permit infection of alternative hosts. The secondary-host paradigm (a) argues that a nonhuman host is infected by a bat progenitor virus and, through adaptation, facilitates transmission to humans; subsequent replication in humans leads to the epidemic viral strain. The direct paradigm (b) suggests that transmission occurs between bats and humans without the requirement of an intermediate host; selection then occurs in the human population with closely related viruses replicating in a secondary host, permitting continued viral persistence and adaptation in both. (c) The data from chimeric SARS-like viruses argue that the quasi-species pools maintain multiple viruses capable of infecting human cells without the need for mutations (red circles). Although adaptations in secondary or human hosts may be required for epidemic emergence, if SHC014 spike–containing viruses recombined with virulent CoV backbones (circles with green outlines), then epidemic disease may be the result in humans. Existing data support elements of all three paradigms.
Although our study does not invalidate the other emergence routes, it does argue for a third paradigm in which circulating bat CoV pools maintain ‘poised’ spike proteins that are capable of infecting humans without mutation or adaptation (Fig. 4c). This hypothesis is illustrated by the ability of a chimeric virus containing the SHC014 spike in a SARS-CoV backbone to cause robust infection in both human airway cultures and in mice without RBD adaptation. Coupled with the observation of previously identified pathogenic CoV backbones3,20, our results suggest that the starting materials required for SARS-like emergent strains are currently circulating in animal reservoirs. Notably, although full-length SHC014-CoV probably requires additional backbone adaption to mediate human disease, the documented high-frequency recombination events in CoV families underscores the possibility of future emergence and the need for further preparation.
To date, genomics screens of animal populations have primarily been used to identify novel viruses in outbreak settings21. The approach here extends these data sets to examine questions of viral emergence and therapeutic efficacy. We consider viruses with the SHC014 spike a potential threat owing to their ability to replicate in primary human airway cultures, the best available model for human disease. In addition, the observed pathogenesis in mice indicates a capacity for SHC014-containing viruses to cause disease in mammalian models, without RBD adaptation. Notably, differential tropism in the lung as compared to that with SARS-MA15 and attenuation of full-length SHC014-CoV in HAE cultures relative to SARS-CoV Urbani suggest that factors beyond ACE2 binding—including spike processivity, receptor bio-availability or antagonism of the host immune responses—may contribute to emergence. However, further testing in nonhuman primates is required to translate these finding into pathogenic potential in humans. Importantly, the failure of available therapeutics defines a critical need for further study and for the development of treatments. With this knowledge, surveillance programs, diagnostic reagents and effective treatments can be produced that are protective against the emergence of group 2b–specific CoVs, such as SHC014, and these can be applied to other CoV branches that maintain similarly heterogeneous pools.
In addition to offering preparation against future emerging viruses, this approach must be considered in the context of the US government–mandated pause on gain-of-function (GOF) studies22. On the basis of previous models of emergence (Fig. 4a,b), the creation of chimeric viruses such as SHC014-MA15 was not expected to increase pathogenicity. Although SHC014-MA15 is attenuated relative to its parental mouse-adapted SARS-CoV, similar studies examining the pathogenicity of CoVs with the wild-type Urbani spike within the MA15 backbone showed no weight loss in mice and reduced viral replication23. Thus, relative to the Urbani spike–MA15 CoV, SHC014-MA15 shows a gain in pathogenesis (Fig. 1). On the basis of these findings, scientific review panels may deem similar studies building chimeric viruses based on circulating strains too risky to pursue, as increased pathogenicity in mammalian models cannot be excluded. Coupled with restrictions on mouse-adapted strains and the development of monoclonal antibodies using escape mutants, research into CoV emergence and therapeutic efficacy may be severely limited moving forward. Together, these data and restrictions represent a crossroads of GOF research concerns; the potential to prepare for and mitigate future outbreaks must be weighed against the risk of creating more dangerous pathogens. In developing policies moving forward, it is important to consider the value of the data generated by these studies and whether these types of chimeric virus studies warrant further investigation versus the inherent risks involved.
Overall, our approach has used metagenomics data to identify a potential threat posed by the circulating bat SARS-like CoV SHC014. Because of the ability of chimeric SHC014 viruses to replicate in human airway cultures, cause pathogenesis in vivo and escape current therapeutics, there is a need for both surveillance and improved therapeutics against circulating SARS-like viruses. Our approach also unlocks the use of metagenomics data to predict viral emergence and to apply this knowledge in preparing to treat future emerging virus infections.
Methods
Viruses, cells, in vitro infection and plaque assays.
Wild-type SARS-CoV (Urbani), mouse-adapted SARS-CoV (MA15) and chimeric SARS-like CoVs were cultured on Vero E6 cells (obtained from United States Army Medical Research Institute of Infectious Diseases), grown in Dulbecco’s modified Eagle’s medium (DMEM) (Gibco, CA) and 5% fetal clone serum (FCS) (Hyclone, South Logan, UT) along with antibiotic/antimycotic (Gibco, Carlsbad, CA). DBT cells (Baric laboratory, source unknown) expressing ACE2 orthologs have been previously described for both human and civet; bat Ace2 sequence was based on that from Rhinolophus leschenaulti, and DBT cells expressing bat Ace2 were established as described previously8. Pseudotyping experiments were similar to those using an HIV-based pseudovirus, prepared as previously described10, and examined on HeLa cells (Wuhan Institute of Virology) that expressed ACE2 orthologs. HeLa cells were grown in minimal essential medium (MEM) (Gibco, CA) supplemented with 10% FCS (Gibco, CA) as previously described24. Growth curves in Vero E6, DBT, Calu-3 2B4 and primary human airway epithelial cells were performed as previously described8,25. None of the working cell line stocks were authenticated or tested for mycoplasma recently, although the original seed stocks used to create the working stocks are free from contamination. Human lungs for HAE cultures were procured under University of North Carolina at Chapel Hill Institutional Review Board–approved protocols. HAE cultures represent highly differentiated human airway epithelium containing ciliated and non-ciliated epithelial cells as well as goblet cells. The cultures are also grown on an air-liquid interface for several weeks before use, as previously described26. Briefly, cells were washed with PBS and inoculated with virus or mock-diluted in PBS for 40 min at 37 °C. After inoculation, cells were washed three times and fresh medium was added to signify time ‘0’. Three or more biological replicates were harvested at each described time point. No blinding was used in any sample collections nor were samples randomized. All virus cultivation was performed in a biosafety level (BSL) 3 laboratory with redundant fans in the biosafety cabinets, as described previously by our group2. All personnel wore powered air purifying respirators (Breathe Easy, 3M) with Tyvek suits, aprons and booties and were double-gloved.
Sequence clustering and structural modeling.
The full-length genomic sequences and the amino acid sequences of the S1 domains of the spike of representative CoVs were downloaded from Genbank or Pathosystems Resource Integration Center (PATRIC), aligned with ClustalX and phylogenetically compared by using maximum likelihood estimation using 100 bootstraps or by using the PhyML (https://code.google.com/p/phyml/) package, respectively. The tree was generated using maximum likelihood with the PhyML package. The scale bar represents nucleotide substitutions. Only nodes with bootstrap support above 70% are labeled. The tree shows that CoVs are divided into three distinct phylogenetic groups defined as α-CoVs, β-CoVs and γ-CoVs. Classical subgroup clusters are marked as 2a, 2b, 2c and 2d for β-CoVs, and 1a and 1b for the α-CoVs. Structural models were generated using Modeller (Max Planck Institute Bioinformatics Toolkit) to generate homology models for SHC014 and Rs3367 of the SARS RBD in complex with ACE2 based on crystal structure 2AJF (Protein Data Bank). Homology models were visualized and manipulated in MacPyMol (version 1.3).
Construction of SARS-like chimeric viruses.
Both wild-type and chimeric viruses were derived from either SARS-CoV Urbani or the corresponding mouse-adapted (SARS-CoV MA15) infectious clone (ic) as previously described27. Plasmids containing spike sequences for SHC014 were extracted by restriction digest and ligated into the E and F plasmid of the MA15 infectious clone. The clone was designed and purchased from Bio Basic as six contiguous cDNAs using published sequences flanked by unique class II restriction endonuclease sites (BglI). Thereafter, plasmids containing wild-type, chimeric SARS-CoV and SHC014-CoV genome fragments were amplified, excised, ligated and purified. In vitro transcription reactions were then preformed to synthesize full-length genomic RNA, which was transfected into Vero E6 cells as previously described2. The medium from transfected cells was harvested and served as seed stocks for subsequent experiments. Chimeric and full-length viruses were confirmed by sequence analysis before use in these studies. Synthetic construction of chimeric mutant and full-length SHC014-CoV was approved by the University of North Carolina Institutional Biosafety Committee and the Dual Use Research of Concern committee.
Ethics statement.
This study was carried out in accordance with the recommendations for the care and use of animals by the Office of Laboratory Animal Welfare (OLAW), NIH. The Institutional Animal Care and Use Committee (IACUC) of The University of North Carolina at Chapel Hill (UNC, Permit Number A-3410-01) approved the animal study protocol (IACUC #13-033) used in these studies.
Mice and in vivo infection.
Female, 10-week-old and 12-month-old BALB/cAnNHsD mice were ordered from Harlan Laboratories. Mouse infections were done as previously described20. Briefly, animals were brought into a BSL3 laboratory and allowed to acclimate for 1 week before infection. For infection and live-attenuated virus vaccination, mice were anesthetized with a mixture of ketamine and xylazine and infected intranasally, when challenged, with 50 μl of phosphate-buffered saline (PBS) or diluted virus with three or four mice per time point, per infection group per dose as described in the figure legends. For individual mice, notations for infection including failure to inhale the entire dose, bubbling of inoculum from the nose, or infection through the mouth may have led to exclusion of mouse data at the discretion of the researcher; post-infection, no other pre-established exclusion or inclusion criteria are defined. No blinding was used in any animal experiments, and animals were not randomized. For vaccination, young and aged mice were vaccinated by footpad injection with a 20-μl volume of either 0.2 μg of double-inactivated SARS-CoV vaccine with alum or mock PBS; mice were then boosted with the same regimen 22 d later and challenged 21 d thereafter. For all groups, as per protocol, animals were monitored daily for clinical signs of disease (hunching, ruffled fur and reduced activity) for the duration of the experiment. Weight loss was monitored daily for the first 7 d, after which weight monitoring continued until the animals recovered to their initial starting weight or displayed weight gain continuously for 3 d. All mice that lost greater than 20% of their starting body weight were ground-fed and further monitored multiple times per day as long as they were under the 20% cutoff. Mice that lost greater than 30% of their starting body weight were immediately sacrificed as per protocol. Any mouse deemed to be moribund or unlikely to recover was also humanely sacrificed at the discretion of the researcher. Euthanasia was performed using an isoflurane overdose and death was confirmed by cervical dislocation. All mouse studies were performed at the University of North Carolina (Animal Welfare Assurance #A3410-01) using protocols approved by the UNC Institutional Animal Care and Use Committee (IACUC).
Histological analysis.
The left lung was removed and submerged in 10% buffered formalin (Fisher) without inflation for 1 week. Tissues were embedded in paraffin and 5-μm sections were prepared by the UNC Lineberger Comprehensive Cancer Center histopathology core facility. To determine the extent of antigen staining, sections were stained for viral antigen using a commercially available polyclonal SARS-CoV anti-nucleocapsid antibody (Imgenex) and scored in a blinded manner by for staining of the airway and parenchyma as previously described20. Images were captured using an Olympus BX41 microscope with an Olympus DP71 camera.
Virus neutralization assays.
Plaque reduction neutralization titer assays were performed with previously characterized antibodies against SARS-CoV, as previously described11,12,13. Briefly, neutralizing antibodies or serum was serially diluted twofold and incubated with 100 p.f.u. of the different infectious clone SARS-CoV strains for 1 h at 37 °C. The virus and antibodies were then added to a 6-well plate with 5 × 105 Vero E6 cells/well with multiple replicates (n ≥ 2). After a 1-h incubation at 37 °C, cells were overlaid with 3 ml of 0.8% agarose in medium. Plates were incubated for 2 d at 37 °C, stained with neutral red for 3 h and plaques were counted. The percentage of plaque reduction was calculated as (1 − (no. of plaques with antibody/no. of plaques without antibody)) × 100.
Statistical analysis.
All experiments were conducted contrasting two experimental groups (either two viruses, or vaccinated and unvaccinated cohorts). Therefore, significant differences in viral titer and histology scoring were determined by a two-tailed Student’s t-test at individual time points. Data was normally distributed in each group being compared and had similar variance.
Biosafety and biosecurity.
Reported studies were initiated after the University of North Carolina Institutional Biosafety Committee approved the experimental protocol (Project Title: Generating infectious clones of bat SARS-like CoVs; Lab Safety Plan ID: 20145741; Schedule G ID: 12279). These studies were initiated before the US Government Deliberative Process Research Funding Pause on Selected Gain-of-Function Research Involving Influenza, MERS and SARS Viruses (http://www.phe.gov/s3/dualuse/Documents/gain-of-function.pdf). This paper has been reviewed by the funding agency, the NIH. Continuation of these studies was requested, and this has been approved by the NIH.
SARS-CoV is a select agent. All work for these studies was performed with approved standard operating procedures (SOPs) and safety conditions for SARS-CoV, MERs-CoV and other related CoVs. Our institutional CoV BSL3 facilities have been designed to conform to the safety requirements that are recommended in the Biosafety in Microbiological and Biomedical Laboratories (BMBL), the US Department of Health and Human Services, the Public Health Service, the Centers for Disease Control (CDC) and the NIH. Laboratory safety plans were submitted to, and the facility has been approved for use by, the UNC Department of Environmental Health and Safety (EHS) and the CDC. Electronic card access is required for entry into the facility. All workers have been trained by EHS to safely use powered air purifying respirators (PAPRs), and appropriate work habits in a BSL3 facility and active medical surveillance plans are in place. Our CoV BSL3 facilities contain redundant fans, emergency power to fans and biological safety cabinets and freezers, and our facilities can accommodate SealSafe mouse racks. Materials classified as BSL3 agents consist of SARS-CoV, bat CoV precursor strains, MERS-CoV and mutants derived from these pathogens. Within the BSL3 facilities, experimentation with infectious virus is performed in a certified Class II Biosafety Cabinet (BSC). All members of the staff wear scrubs, Tyvek suits and aprons, PAPRs and shoe covers, and their hands are double-gloved. BSL3 users are subject to a medical surveillance plan monitored by the University Employee Occupational Health Clinic (UEOHC), which includes a yearly physical, annual influenza vaccination and mandatory reporting of any symptoms associated with CoV infection during periods when working in the BSL3. All BSL3 users are trained in exposure management and reporting protocols, are prepared to self-quarantine and have been trained for safe delivery to a local infectious disease management department in an emergency situation. All potential exposure events are reported and investigated by EHS and UEOHC, with reports filed to both the CDC and the NIH.
Accession codes
Accessions
Protein Data Bank
- 2AJFChange history
20 November 2015
In the version of this article initially published online, the authors omitted to acknowledge a funding source, USAID-EPT-PREDICT funding from EcoHealth Alliance, to Z.-L.S. The error has been corrected for the print, PDF and HTML versions of this article.
References
- 1
Ge, X.Y. et al. Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor. Nature 503, 535–538 (2013).
- CAS
- Article
- Google Scholar
- 2
Yount, B. et al. Reverse genetics with a full-length infectious cDNA of severe acute respiratory syndrome coronavirus. Proc. Natl. Acad. Sci. USA 100, 12995–13000 (2003).
- CAS
- Article
- Google Scholar
- 3
Becker, M.M. et al. Synthetic recombinant bat SARS-like coronavirus is infectious in cultured cells and in mice. Proc. Natl. Acad. Sci. USA 105, 19944–19949 (2008).
- CAS
- Article
- Google Scholar
- 4
Peiris, J.S., Guan, Y. & Yuen, K.Y. Severe acute respiratory syndrome. Nat. Med. 10, S88–S97 (2004).
- CAS
- Article
- Google Scholar
- 5
Al-Tawfiq, J.A. et al. Surveillance for emerging respiratory viruses. Lancet Infect. Dis. 14, 992–1000 (2014).
- Article
- Google Scholar
- 6
He, B. et al. Identification of diverse alphacoronaviruses and genomic characterization of a novel severe acute respiratory syndrome–like coronavirus from bats in China. J. Virol. 88, 7070–7082 (2014).
- Article
- Google Scholar
- 7
Li, F. Receptor recognition and cross-species infections of SARS coronavirus. Antiviral Res. 100, 246–254 (2013).
- CAS
- Article
- Google Scholar
- 8
Sheahan, T. et al. Mechanisms of zoonotic severe acute respiratory syndrome coronavirus host range expansion in human airway epithelium. J. Virol. 82, 2274–2285 (2008).
- CAS
- Article
- Google Scholar
- 9
Yoshikawa, T. et al. Dynamic innate immune responses of human bronchial epithelial cells to severe acute respiratory syndrome–associated coronavirus infection. PLoS ONE 5, e8729 (2010).
- Article
- Google Scholar
- 10
Qiu, X. et al. Reversion of advanced Ebola virus disease in nonhuman primates with ZMapp. Nature 514, 47–53 (2014).
- CAS
- Article
- Google Scholar
- 11
Sui, J. et al. Broadening of neutralization activity to directly block a dominant antibody-driven SARS-coronavirus evolution pathway. PLoS Pathog. 4, e1000197 (2008).
- Article
- Google Scholar
- 12
Sui, J. et al. Effects of human anti–spike protein receptor binding domain antibodies on severe acute respiratory syndrome coronavirus neutralization escape and fitness. J. Virol. 88, 13769–13780 (2014).
- Article
- Google Scholar
- 13
Rockx, B. et al. Escape from human monoclonal antibody neutralization affects in vitro and in vivo fitness of severe acute respiratory syndrome coronavirus. J. Infect. Dis. 201, 946–955 (2010).
- CAS
- Article
- Google Scholar
- 14
Spruth, M. et al. A double-inactivated whole-virus candidate SARS coronavirus vaccine stimulates neutralizing and protective antibody responses. Vaccine 24, 652–661 (2006).
- CAS
- Article
- Google Scholar
- 15
Bolles, M. et al. A double-inactivated severe acute respiratory syndrome coronavirus vaccine provides incomplete protection in mice and induces increased eosinophilic proinflammatory pulmonary response upon challenge. J. Virol. 85, 12201–12215 (2011).
- CAS
- Article
- Google Scholar
- 16
Siegrist, C.-A. in Vaccines 6th edn. (eds. Plotkin, S.A., Orenstein, W.A. & Offit, P.A.) 14–32 (W.B. Saunders, 2013).
- 17
Deming, D. et al. Vaccine efficacy in senescent mice challenged with recombinant SARS-CoV bearing epidemic and zoonotic spike variants. PLoS Med. 3, e525 (2006).
- Article
- Google Scholar
- 18
Graham, R.L., Donaldson, E.F. & Baric, R.S. A decade after SARS: strategies for controlling emerging coronaviruses. Nat. Rev. Microbiol. 11, 836–848 (2013).
- CAS
- Article
- Google Scholar
- 19
Graham, R.L. & Baric, R.S. Recombination, reservoirs and the modular spike: mechanisms of coronavirus cross-species transmission. J. Virol. 84, 3134–3146 (2010).
- CAS
- Article
- Google Scholar
- 20
Agnihothram, S. et al. A mouse model for betacoronavirus subgroup 2c using a bat coronavirus strain HKU5 variant. MBio 5, e00047-14 (2014).
- Article
- Google Scholar
- 21
Relman, D.A. Metagenomics, infectious disease diagnostics and outbreak investigations: sequence first, ask questions later? J. Am. Med. Assoc. 309, 1531–1532 (2013).
- CAS
- Article
- Google Scholar
- 22
Kaiser, J. Moratorium on risky virology studies leaves work at 14 institutions in limbo. ScienceInsider http://news.sciencemag.org/biology/2014/11/moratorium-risky-virology-studies-leaves-work-14-institutions-limbo (2014).
- 23
Frieman, M. et al. Molecular determinants of severe acute respiratory syndrome coronavirus pathogenesis and virulence in young and aged mouse models of human disease. J. Virol. 86, 884–897 (2012).
- CAS
- Article
- Google Scholar
- 24
Ren, W. et al. Difference in receptor usage between severe acute respiratory syndrome (SARS) coronavirus and SARS-like coronavirus of bat origin. J. Virol. 82, 1899–1907 (2008).
- CAS
- Article
- Google Scholar
- 25
Sims, A.C. et al. Release of severe acute respiratory syndrome coronavirus nuclear import block enhances host transcription in human lung cells. J. Virol. 87, 3885–3902 (2013).
- CAS
- Article
- Google Scholar
- 26
Fulcher, M.L., Gabriel, S., Burns, K.A., Yankaskas, J.R. & Randell, S.H. Well-differentiated human airway epithelial cell cultures. Methods Mol. Med. 107, 183–206 (2005).
- CAS
- PubMed
- Google Scholar
- 27
Roberts, A. et al. A mouse-adapted SARS-coronavirus causes disease and mortality in BALB/c mice. PLoS Pathog. 3, e5.
- Article
- Google Scholar
Download references
Acknowledgements
Research in this manuscript was supported by grants from the National Institute of Allergy & Infectious Disease and the National Institute of Aging of the US National Institutes of Health (NIH) under awards U19AI109761 (R.S.B.), U19AI107810 (R.S.B.), AI085524 (W.A.M.), F32AI102561 (V.D.M.) and K99AG049092 (V.D.M.), and by the National Natural Science Foundation of China awards 81290341 (Z.-L.S.) and 31470260 (X.-Y.G.), and by USAID-EPT-PREDICT funding from EcoHealth Alliance (Z.-L.S.). Human airway epithelial cultures were supported by the National Institute of Diabetes and Digestive and Kidney Disease of the NIH under award NIH DK065988 (S.H.R.). We also thank M.T. Ferris (Dept. of Genetics, University of North Carolina) for the reviewing of statistical approaches and C.T. Tseng (Dept. of Microbiology and Immunology, University of Texas Medical Branch) for providing Calu-3 cells. Experiments with the full-length and chimeric SHC014 recombinant viruses were initiated and performed before the GOF research funding pause and have since been reviewed and approved for continued study by the NIH. The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Author information
Affiliations
- Department of Epidemiology, University of North Carolina at Chapel Hill, Chapel Hill, North Carolina, USA
- Vineet D Menachery
- , Boyd L Yount Jr
- , Kari Debbink
- , Lisa E Gralinski
- , Jessica A Plante
- , Rachel L Graham
- , Trevor Scobey
- , Eric F Donaldson
- & Ralph S Baric
- Department of Microbiology and Immunology, University of North Carolina at Chapel Hill, Chapel Hill, North Carolina, USA
- Kari Debbink
- & Ralph S Baric
- National Center for Toxicological Research, Food and Drug Administration, Jefferson, Arkansas, USA
- Sudhakar Agnihothram
- Key Laboratory of Special Pathogens and Biosafety, Wuhan Institute of Virology, Chinese Academy of Sciences, Wuhan, China
- Xing-Yi Ge
- & Zhengli-Li Shi
- Department of Cell Biology and Physiology, University of North Carolina at Chapel Hill, Chapel Hill, North Carolina, USA
- Scott H Randell
- Cystic Fibrosis Center, Marsico Lung Institute, University of North Carolina at Chapel Hill, Chapel Hill, North Carolina, USA
- Scott H Randell
- Institute for Research in Biomedicine, Bellinzona Institute of Microbiology, Zurich, Switzerland
- Antonio Lanzavecchia
- Department of Cancer Immunology and AIDS, Dana-Farber Cancer Institute, Harvard Medical School, Boston, Massachusetts, USA
- Wayne A Marasco
- Department of Medicine, Harvard Medical School, Boston, Massachusetts, USA
- Wayne A Marasco
Contributions
V.D.M. designed, coordinated and performed experiments, completed analysis and wrote the manuscript. B.L.Y. designed the infectious clone and recovered chimeric viruses; S.A. completed neutralization assays; L.E.G. helped perform mouse experiments; T.S. and J.A.P. completed mouse experiments and plaque assays; X.-Y.G. performed pseudotyping experiments; K.D. generated structural figures and predictions; E.F.D. generated phylogenetic analysis; R.L.G. completed RNA analysis; S.H.R. provided primary HAE cultures; A.L. and W.A.M. provided critical monoclonal antibody reagents; and Z.-L.S. provided SHC014 spike sequences and plasmids. R.S.B. designed experiments and wrote manuscript.
Corresponding authors
Correspondence to Vineet D Menachery or Ralph S Baric.
Ethics declarations
Competing interests
The authors declare no competing financial interests.
Supplementary information
Supplementary Text and Figures
Supplementary Figures 1–6 and Supplementary Tables 1–4 (PDF 4747 kb)
Rights and permissions
About this article
Cite this article
Menachery, V., Yount, B., Debbink, K. et al. A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence. Nat Med 21, 1508–1513 (2015). https://doi.org/10.1038/nm.3985
Download citation
- Received
- Accepted
- Published
- Issue Date
- DOIhttps://doi.org/10.1038/nm.3985
Share this article
Anyone you share the following link with will be able to read this content:
Duff has traveled extensively, is published around the world and is a regular guest on TV and radio in more than “several” countries. He is also a trained chef, wine enthusiast, avid motorcyclist and gunsmith specializing in historical weapons and restoration. Business experience and interests are in energy and defense technology.
Gordon’s Archives – 2008-2014